
【题目】下列说法正确的是( ) 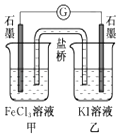
A.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
B.标准状况下,2.24LCCl4分子中共价键的数目为0.4×6.02×1023
C.控制适合的条件,将反应2Fe3++2I﹣═2Fe2++I2设计成如图所示的原电池.当电流汁读数为零后,在甲中溶入FeCl2固体,则乙中石墨电极为负极
D.向盛有2mL饱和H2S溶液的两支试管中分别滴加1滴浓度均为0.1mol/L的ZnSO4溶液和CuSO4溶液,有CuS生成而无ZnS生成,则Ksp(CuS)<Ksp(ZnS)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高铁电池是电动汽车首选的电池之一,该电池的工作原理为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是( )
A.高铁电池产生的电流从负极经外电路到达正极
B.正极反应式为Zn+2OH﹣﹣2e﹣═Zn(OH)2
C.负极pH减小,正极pH增大,电解液pH增大
D.每氧化1mol高铁酸钾转移3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X和Y均为元素周期表前20号元素,X2-和Yˉ离子具有相同的电子层结构。下列正确的是:
A. 原子半径 X<YB. 离子半径X2->Yˉ
C. 质子数X>YD. 氢化物的稳定性H2X >HY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种化合物,其焰色反应的火焰均为黄色。其中C是一种淡黄色固体,加热固体A可生成D,同时得到能使澄清石灰水变浑浊的无色气体。A与B溶液混合后可得到D。
(1)写出下列物质的化学式:A、_______;B、_______;C、_______;D、_______。
(2)写出A与B反应的离子方程式:_________________________________________。
(3)在甲、乙、丙、丁四个烧杯中各加入100 mL水,再分别加入0.1 mol 的下列物质:①钠、②氧化钠、③过氧化钠、④氢氧化钠,固体完全溶解后,四个烧杯中溶质的质量分数由大到小的顺序是(填编号)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列微粒半径大小比较正确的是( )
A. Na+<Mg2+<Al3+<O2-
B. S2->Cl->Na+>Al3+
C. Na<Mg<Al<S
D. Ca<Rb<K<Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块铝片加入某盐酸溶液中,铝片完全溶解,在所得溶液中继续滴加NaOH溶液。生成Al(OH)3的量与加入的NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
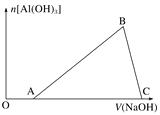
A. C点的溶质只有NaAlO2
B. 图中B点之前发生的离子反应为Al3++3OH-===Al(OH)3↓
C. A→B段消耗的NaOH溶液体积与B→C段消耗的NaOH溶液体积比=3∶1
D. 溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变)( )
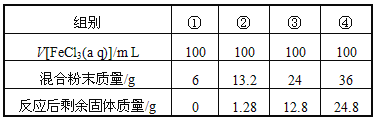
A. 第①组充分反应后溶液中c(Fe3+)=2.0 mol/L
B. 第②组剩余固体是铜铁混合物
C. 第④组反应后的滤液中c(Fe2+)=5 mol/L
D. 原混合粉末中n(Fe):n(Cu)=2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ba(OH)2(固态)、CuSO4(固态)、CH3COOH(液态)可以归为一类,则下列物质还可以和它们归为一类的是
A. 75%的酒精溶液 B. 硝酸钠(固态) C. Fe(OH)3 胶体 D. 豆浆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com