
| A、v(N2)正=v(NH3)逆 |
| B、单位时间内3mol H-H键断裂,同时2mol N-H键断裂 |
| C、n(N2):n(H2):(NH3)=1:3:2 |
| D、反应混合物各组分的物质的量浓度不再改变 |


科目:高中化学 来源: 题型:
 龙胆酸甲酯是制取抗心律失常药物--氟卜尼的中间体.已知龙胆酸甲酯结构如图所示.
龙胆酸甲酯是制取抗心律失常药物--氟卜尼的中间体.已知龙胆酸甲酯结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子式为C11H12O4 |
| B、苯环上的一氯代物有2种 |
| C、分子中所有的碳原子可能共平面 |
| D、能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A、α-鸢尾酮可与某种酚互为同分异构体 |
| B、1 mol α-鸢尾酮最多可与3molH2加成 |
| C、α-鸢尾酮可发生加成反应、消去、氧化反应 |
D、α-鸢尾酮经加氢→消去→加氢三步反应可转变为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其他条件不变,加催化剂与不加催化剂其△H相同 |
| B、当达到平衡,向体系中充入CO2其平衡向左移动 |
| C、理论上该反应可设计成燃料电池,H2O(g)在正极上发生还原反应 |
| D、平衡混合气体通入NaOH溶液恰好反应,升高温度溶液碱性增强,其pH一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.3mol/L |
| B、Y为0.35mol/L |
| C、X为0.2mol/L |
| D、Z为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
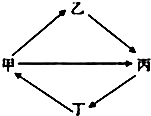 下列各组物质按如图所示转化关系每一个转化都能一步实现的是( )
下列各组物质按如图所示转化关系每一个转化都能一步实现的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | S | SO2 | H2SO4 | SO3 |
| B | CO2 | Na2CO3 | NaHCO3 | CaCO3 |
| C | N2 | HNO3 | NO2 | NH3 |
| D | SiO2 | Na2SiO3 | H2SiO3 | CaSiO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com