
【题目】海水中含量最多的氯化物是
A.NaClB.MgCl2C.KClD.CaCl2
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
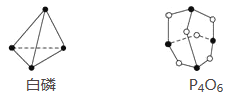
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁是四种中学化学中常见的物质,其转化关系如图所示。则甲和丁不可能是
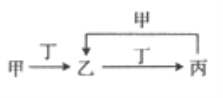
A. N2和O2 B. Cl2和Fe C. C和O2 D. SO2和NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物理量与其相应的单位不匹配的是
A.摩尔质量:g /molB.气体摩尔体积:L/mol
C.物质的量:molD.物质的量浓度:L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Mg(NO3)2和Al(NO3)3的混合溶液中,NO3﹣的物质的量为0.7mol.向该溶液中加入100mL 8molL﹣1的KOH溶液,使之充分反应,反应前,若Al3+的物质的量与混合溶液中离子总物质的量的比值为x. (不考虑Mg2+和Al3+的水解及水的电离所引起的离子总数的变化)
(1)x的取值范围是 .
(2)当KOH刚好完全消耗,且Al3+全部转化为AlO2﹣时,x的取值范围 .
(3)将(2)中的x值记为x1 , 则: 当0<x<x1时,反应生成的沉淀物的化学式为 .
当x>x1时反应生成的沉淀物的化学式为
(4)若反应前Al3+的物质的量为a mol,则a=(用含x的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2 , 含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下: 
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 , 植物粉的作用是 .
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5; ②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+ , 而且能提高软锰矿的浸出率.写出双氧水提高软锰矿浸出率的离子方程式 .
(3)制备:在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀.温度控制35℃以下的原因是;该反应的化学方程式为;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 .
(4)计算:室温下,Ksp(MnCO3)=1.8×10﹣11 , Ksp(MgCO3)=2.6×10﹣5 , 已知离子浓度小于1.0×10﹣5molL﹣1时,表示该离子沉淀完全.若净化液中的c(Mg2+)=10﹣2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七种元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
请回答:
(1)②所代表元素的名称为______
(2)七种元素中,非金属性最强的元素是______(填元素符号),最高价氧化物的水化物酸性最强的是_______(填化学式),最高正化合价与最低负化合价的代数和为4的元素是_______(填元素符号)。
(3)②、④、⑥所对应元素中原子半径最小的是______(填元素符号),简单离子半径最大的是______(填离子符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com