
【题目】下列比较中正确的是( )
A.离子还原性:S2->Cl->Br->I-
B.氧化性:F2>Cl2>Br2>S
C.酸性:H2SO4>HClO4>H3PO4
D.非金属性:F>Cl>S>O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】没有水,人体内大部分化学反应就无法进行,这说明 ( )
A.水在生物体内可以流动
B.生物体内的生化反应必须在水中进行
C.水是细胞内含量最多的化合物
D.水具有缓和温度变化的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的氮循环如图所示,下列说法不正确的是

A. 氧元素参与了氮循环
B. ②中合成氨属于人工固氮
C. ①和③中氮元素均被氧化
D. 含氮有机物和含氮无机物可相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对药物的认识和使用的说法,正确的是( )
A.麻黄碱属于非处方药
B.感冒时服用适量阿司匹林
C.冰毒和海洛因不是毒品
D.大部分药物都没有毒副作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A.甲烷的电子式: 
B.氟原子的结构示意图: ![]()
C.乙烯的结构简式:CH2CH2
D.碳酸钠的电离方程式:Na2CO3=Na2++CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
I.污染物SO2、NO2经O2预处理后用CaSO3悬浊液吸收,可减少尾气中SO2、NOx的含量。
T℃时,O2氧化烟气中SO2、NOx的主要反应的热化学方程式为:

(1)T℃时,反应3NO(g)+O3(g) ![]() 3NO2(g)的△H=_______________kJ.mol-1。
3NO2(g)的△H=_______________kJ.mol-1。
(2)T℃时,将0.6molNO和0.2molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
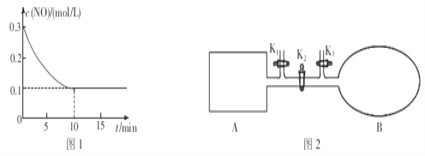
①T℃时,反应3NO(g)+O3(g)![]() 3NO2(g)的平衡常数K=______________。
3NO2(g)的平衡常数K=______________。
②不能说明反应达到平衡状态的是______________。
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1:3
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题:
(3)如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL(忽略导管中的气体体积)。
①若容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)=________________。
②若打开K2,平衡后B容器的体积缩至0.4aL,则打开K2之前,气球B体积为__________L。
③若平衡后在A容器中再充入0.5molN2O4,则重新到达平衡后,平衡混合气中NO2的体积分数______________(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行l0 min,溶液的pH由7变为l 2。
①N2的结构式为
②上述反应的离子方程式为 ,其平均反应速率v(NO3-)为 mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如下图所示。

①电源正极为 (填“A”或“B”),阴极反应式为:
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:下列结论错误的是_________(填序号)
①单质的熔点:Li>Na>K ②氢化物的稳定性:HF>H2S>PH3>SiH4
③还原性:H2S>HCl>HBr>HI ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥密度:F2>Cl2>Br2 ⑦沸点:NH3>PH3
Ⅱ:(1)下列几种物质: ①MgCl2 ②HCl ③Na ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦NH3 ⑧I2 ⑨Ne。含有非极性共价键的离子化合物是___________;不存在化学键的是__________。(填序号)
(2)CO2的电子式为__________;NH3的结构式为__________;
(3)分析在下列变化中,微粒间作用力的变化(填选项):
①碘的升华破坏______________ ②HCl溶于水破坏_________________。
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力
Ⅲ:(1)下列变化完全符合下图图示的是:_______________。(填选项)
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④生石灰溶于水 ⑤二氧化碳与灼热的碳反应 ⑥碘的升华 ⑦Ba(OH)2·8H2O与NH4Cl反应
A.①②⑥ B.②⑤⑦ C.①②⑤⑥⑦ D.②⑤⑥⑦

(2)化学反应可视为旧键断裂和新键形成的过程。已知断开1mol下列化学键时需要吸收的能量分别为:P-P a kJ、 P-O b kJ、 O=O c kJ。已知:白磷(P4)和P4O6的分子结构如图所示(分子中所有原子均达到8电子稳定结构)。则1mol白磷(P4)燃烧生成P4O6放出_________kJ热量。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com