
甲、乙两同学分别用NaH2PO4溶液和石灰水,进行混合反应实验,他们各在含0.01molNaH2PO4的溶液中滴加石灰水,甲要使溶液中H2PO4-完全转化为PO43-, 他至少要加入含________mol Ca(OH)2的石灰水,此时发生反应的离子方程式是 _______,乙要使全部PO43-都转化为磷酸钙沉淀,他至少要加入含________molCa(OH)2的石灰水,此时发生反应的离子方程式是________。
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:阅读理解
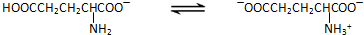
| 5.85(c1V1-c2V2) |
| m |
| 5.85(c1V1-c2V2) |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.| 11 |
| 3 |
| 11 |
| 3 |
查看答案和解析>>
科目:高中化学 来源:2013届福建省莆田一中高三第二次月考化学试卷(带解析) 题型:实验题
(18分)某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验: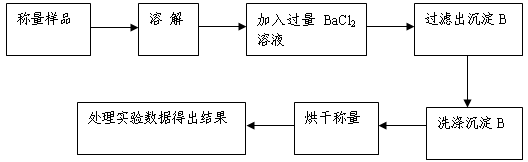
(1)实验时,过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 。
(2)洗涤沉淀B的操作是______________________________________ _
_________________________________________________________________。
(3)在整个实验过程中托盘天平至少使用____ _次。
(4)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为___________ __。
方案Ⅱ.乙组同学的主要实验流程图如下: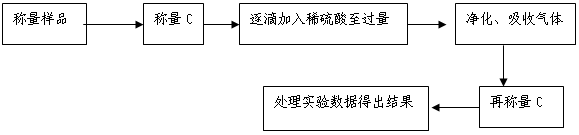
按如下图所示装置进行实验: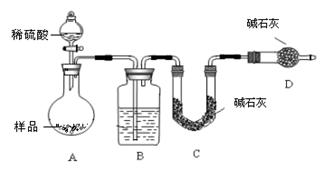
(5)该实验中装置B盛放的物质是_____________________,分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(6)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中吸收净化后气体的干燥管在充分吸收气体前后的质量差____ __。(填“越大”、“越小”或“不变化”)
②D装置的作用是______________ _ _________。
(7)有的同学认为为了减少实验误差,在反应前后都要通人N2(如图),反应后通入N2的目的是 。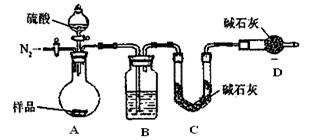
查看答案和解析>>
科目:高中化学 来源:2012届江苏省苏中三市高三5月第二次调研测试化学试卷(带解析) 题型:实验题
谷氨酸一钠盐是味精的主要成分,谷氨酸一钠盐在水溶液中存在如下平衡: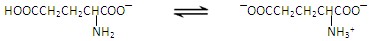
⑴当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。实验室中检验淀粉水解产物可选用的试剂是 。
| A.NaOH溶液、氨水、AgNO3溶液 | B.H2SO4溶液、氨水、AgNO3溶液 |
| C.NaOH溶液、CuSO4溶液 | D.H2SO4溶液、CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高一上学期期末联考化学试卷(解析版) 题型:填空题
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2 g铜。

①请写出铜与稀硝酸反应的离子反应方程式 。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有 。
③仪器c中收集的气体主要是 。(填分子式)
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是 g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。则
①反应结束后的溶液中NO3-的物质的量的取值范围是 。(用含a的代数式等表示)
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+)∶n(Fe2+) 为3∶1,则b/a的值为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com