
A.AX
B.BX
C.AY
D.BY
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
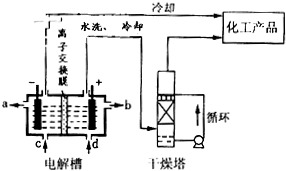
| ||
| ||
| △ |
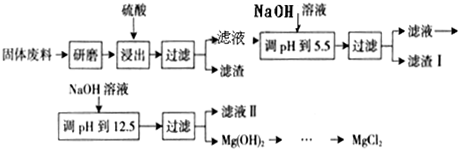
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
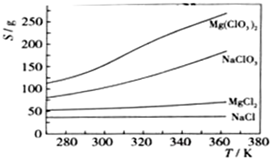
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)现有电解质溶液①Na2CO3,②NaHCO3,③NaAlO2,④CH3COONa,⑤NaOH
(1)当五种溶液的浓度相同时,溶液中由水电离出的H+的物质的量浓度由大到小的顺序是 (填序号)。
(2)在上述五种电解质溶液中,分别加入AlCl3溶液,有气体产生的是 (填序号)。
(3)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第16讲 物质结构与性质练习卷(解析版) 题型:填空题
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题。
(1)写出F元素的电子排布式:___________________________________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为_____________________________________________________________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是_________________。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是____________
______________________________________________________________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省唐山市高三第一次模拟考试理综化学试卷(解析版) 题型:推断题
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______。
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个Na+最近的Na+有____________个。若晶体密度为ρ g·cm-3,阿伏加德罗常的值用NA表示,则Cl-的离子半径_____cm(用含NA与ρ式子表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com