
| 弱酸 | H2CO3 | 水杨酸(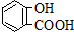 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于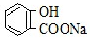 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和  溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→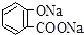 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. |  最多可与2molCO2反应 最多可与2molCO2反应 |
分析 A.相同温度下,酸根离子水解程度越大,其相同浓度的钠盐溶液pH越大;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得 c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)、c(Na+)+c(H+)=c(OH-)+c(C7H5O2-)+2c(C7H4O32-),碳酸的二级电离平衡常数大于水杨酸二级电离平衡常数,所以水解程度CO32-<C7H4O32-,则 溶液碱性强,所以c(H+):Na2CO3溶液>
溶液碱性强,所以c(H+):Na2CO3溶液> 溶液;
溶液;
C.水杨酸二级电离平衡常数小于碳酸,所以酚羟基和碳酸氢根离子不反应,羧基和碳酸氢根离子反应;
D. 与CO2反应只有酚钠反应,而羧钠不反应.
与CO2反应只有酚钠反应,而羧钠不反应.
解答 解:A.相同温度下,酸根离子水解程度越大,其相同浓度的钠盐溶液pH越大,水解程度HCO3->C7H5O2-,所以常温下,等浓度、等体积的NaHCO3溶液pH大于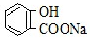 溶液pH,故A错误;
溶液pH,故A错误;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得 c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)、c(Na+)+c(H+)=c(OH-)+c(C7H5O2-)+2c(C7H4O32-),碳酸的二级电离平衡常数大于水杨酸二级电离平衡常数,所以水解程度CO32-<C7H4O32-,则 溶液碱性强,所以c(H+):Na2CO3溶液>
溶液碱性强,所以c(H+):Na2CO3溶液> 溶液,两种溶液中钠离子浓度相等,所以常温下,等浓度、等体积的Na2CO3溶液和
溶液,两种溶液中钠离子浓度相等,所以常温下,等浓度、等体积的Na2CO3溶液和  溶液中所含离子总数前者大于后者,故B错误;
溶液中所含离子总数前者大于后者,故B错误;
C.水杨酸二级电离平衡常数小于碳酸,所以酚羟基和碳酸氢根离子不反应,羧基和碳酸氢根离子反应,反应方程式为 +NaHCO3→
+NaHCO3→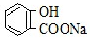 +H2O+CO2↑,故C错误;
+H2O+CO2↑,故C错误;
D. 与CO2反应只有酚钠反应,而羧钠不反应,所以1mol
与CO2反应只有酚钠反应,而羧钠不反应,所以1mol 最多可与1molCO2反应,故D错误;
最多可与1molCO2反应,故D错误;
故无答案.
点评 本题考查了盐类水解的分析判断,弱电解质电离平衡的大小比较分析应用,掌握物质性质和电离程度理解溶液酸碱性,题目难度中等.


科目:高中化学 来源: 题型:解答题


 +(2n-1)H2O.有机物乙在水中的溶解情况是易溶于水(填“不溶于水”、“微溶于水”、“易溶于水”).
+(2n-1)H2O.有机物乙在水中的溶解情况是易溶于水(填“不溶于水”、“微溶于水”、“易溶于水”). +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$
 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$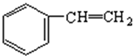 +H2
+H2 .
. .(如不能发生反应,请填“否”;如能发生反应请写出其反应的方程式)
.(如不能发生反应,请填“否”;如能发生反应请写出其反应的方程式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 难溶于水,易溶于乙醚 | |
| B. | 可与NaOH溶液发生水解反应 | |
| C. | 其同分异构体不可能有芳香族化合物 | |
| D. | 分子中含有的官能团是过氧键、醚键和酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
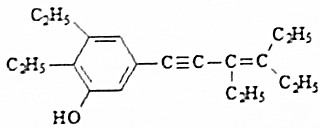
| A. | 该有机物在水中的溶解度小于苯酚在水中的溶解度 | |
| B. | 1mol该有机物可与5mol Br2发生反应 | |
| C. | 该有机物中所有碳原子有可能共面 | |
| D. | 1分子该有机物中有7个碳原子处于同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种有机合成中间体,A的合成路线如图所示,其中B~I分别代表一种有机物.
)是一种有机合成中间体,A的合成路线如图所示,其中B~I分别代表一种有机物.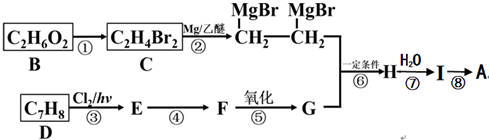
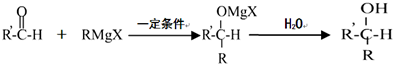
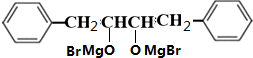 ;
;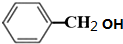 +O2$→_{△}^{铜}$2H2O+2
+O2$→_{△}^{铜}$2H2O+2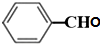 ;
;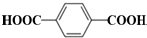 在催化剂的作用下生成聚合物--涤纶,写出涤纶的
在催化剂的作用下生成聚合物--涤纶,写出涤纶的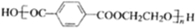 ;
; (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、CuO、HClO、Cu | |
| B. | 水玻璃、Na2O•CaO•6SiO2、Na2O、SO3 | |
| C. | KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH | |
| D. | 普通玻璃、H2O、CH3COOH、葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com