
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M NiOOH + MH 已知:6NiOOH + NH3 + H2O + OH-
NiOOH + MH 已知:6NiOOH + NH3 + H2O + OH- 6Ni(OH)2 + NO2-。下列说法正确的是( )
6Ni(OH)2 + NO2-。下列说法正确的是( )
A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e- Ni(OH)2 + OH-
Ni(OH)2 + OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O + M + e- MH + OH-,H2O中的H被M还原
MH + OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C处分别充入等质量的X、H2、Y三种气体,当隔板静止时,A、C内的气体密度相等,下列说法正确的是
A.X的相对分子质量等于Y的相对分子质量
B.X的相对分子质量比Y的相对分子质量小
C.气体的体积:V(X)>V(H2)>V(Y)
D.物质的量:n(X)<n(H2)<n(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,混合后 得到密度为1.17 g·cm-3的溶液。请计算:
得到密度为1.17 g·cm-3的溶液。请计算:
(1)混合后溶液中NaCl的质量分数为________。
(2)混合后溶液中NaCl的物质的量浓度为________。
(3)在1 000 g水中需加入________mol NaCl,才能使其浓度恰好与上述混合后溶液的浓度相等。(假设密度不变,计算结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.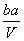 mol·L-1 B.
mol·L-1 B.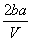 mol·L-1
mol·L-1
C.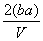 mol·L-1 D.
mol·L-1 D.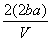 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
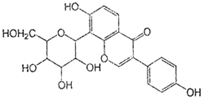
葛根素具有降血压等作用,其结构简式如下图,下列有关说法正确的是( )
A.该物质在一定条件下能发生消去反应、加成反应、取代反应
B.葛根素的分子式为C21H22O9
C.该物质一个分子中含有5个手性碳原子
D.一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐在能源、环保等方面有着广泛的用途。高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。替代传统的净水剂及Cl2对淡水进行净化消毒是城市饮用水处理新技术。
工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解NaOH溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
(1)高铁酸钾具有强氧化性的原因是 ▲ 。
(2)用异丙醇代替水洗涤产品的好处是 ▲ 。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ▲ , ▲ 。
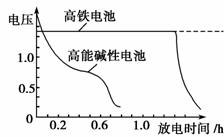
(4)高铁电池是正在研制中的可充电干电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
(5)探究高铁酸钾的某种性质。
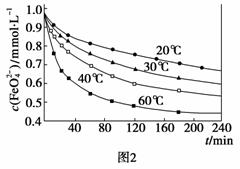
 [实验1]将适量K2FeO4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO
[实验1]将适量K2FeO4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO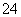 浓度为1.0 mmol·L-1(1 mmol·L-1=10-3 mol·L-1)的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
浓度为1.0 mmol·L-1(1 mmol·L-1=10-3 mol·L-1)的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
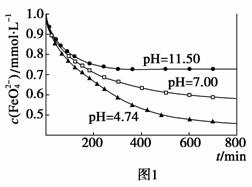
[实验2]将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO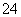 浓度为1.0 mmol·L-1的试样,将试样分别置于20 ℃、30 ℃、40 ℃和60 ℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
浓度为1.0 mmol·L-1的试样,将试样分别置于20 ℃、30 ℃、40 ℃和60 ℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ▲ ;
②实验2可得出的结论是 ▲ ;
③高铁酸钾在水中的反应为4FeO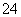 +10H2O
+10H2O 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。
由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
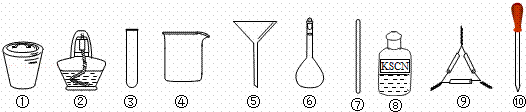
|
| A. | 将茶叶灼烧灰化,选用①、②和⑨ |
|
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
|
| C. | 过滤得到的滤液,选用④、⑤和⑦ |
|
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有如下仪器,仪器中已注入溶液,回答下列问题。
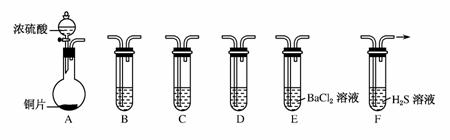
(1)加热装置A,写出铜与浓硫酸反应的化学方 程式_______________________________,烧瓶中的实验现象为________。
程式_______________________________,烧瓶中的实验现象为________。
(2)验证碳、硅非金属性的相对强弱(已知酸性:H2SO3>H2CO3),若选择仪器A、B、C、D并相连接,则B、C、D中所选择的试剂为B________、C________、D________。能说明碳的非金属性比硅强的实验现象是______________________。
(3)验证SO2的氧化性、还原性。若选择A、E、F仪器,并按A、E、F顺序连接。
①则证明SO2有氧化性的实验现象是______________________,反应方程式为______________________________。
②若证明SO2具有还 原性,在E中采取的实验操作为________,其实验现象为________,反应原理为____________________(用离子方程式表示)。
原性,在E中采取的实验操作为________,其实验现象为________,反应原理为____________________(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com