
【题目】镍及其化合物在生产生活中有着极其重要的作用。现以低品位镍红土矿(主要成分为镍的氧化物、Fe2O3·H2O和SiO2等)为原料制备兰尼镍的工艺流程如图所示:
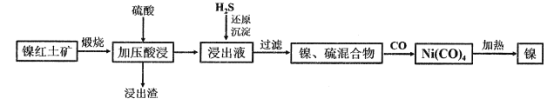
已知加压酸浸过程中的相关影响因素如下:
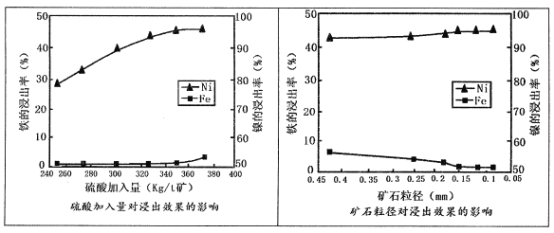
请回答:
(1)请根据图示,选择加压酸浸过程中硫酸的加入量和矿石粒径的最适宜条件为_______
A.260Kg/t矿;0.45mm B.320 Kg/t矿:0.25mm
C.350Kg/t矿;0.15mm D.380 Kg/t矿;0.05mm
(2)①已知镍红土矿煅烧后生成Ni2O3,而加压酸浸后浸出液中含有Ni2+,写出加压酸浸过程中镍元素所涉及的化学反应方程式____________。
②甲同学取该浸出液,控制pH为2~3,经过-系列操作,制取少量NiSO4·7H2O晶体。其控制pH为2~3的目的为____________________________________________________。
③乙同学取该浸出液,经多次处理,得到一定浓度的NiSO4溶液,往其中加入适量的NaClO和NaOH混合液,制得碱性镍电池电极材料NiOOH,该反应的离子方程式为____________。
(3)向浸出液中通入H2S气体,该反应的离子方程式为__________。
(4)下列说法正确的是________________
A.在煅烧过程中,空气宜选择从下往上的通入方式,使镍红土矿燃烧更充分
B.加压酸浸中,为加快反应速率,可选用浓硫酸
C.加压酸浸中,在最适宜条件下,浸出渣中的主要成份为SiO2和Fe2O3·H2O
D.CO为无色无味的有毒气体,故从镍硫混合物到镍的过程中,需注意通风并及时检测操作过程中是否有CO泄露
【答案】C ![]() 抑制镍离子水解防止生成
抑制镍离子水解防止生成![]() 沉淀
沉淀 ![]()
![]() ACD
ACD
【解析】
(1)根据图片可知,在350Kg/t矿的硫酸加入量,0.15mm的矿石粒径时,效果最佳,故答案选C;
(2)①已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有Ni2+,说明Ni元素被还原,另外,在硫酸中只能是O元素被氧化为O2,故有关镍元素的加压酸浸的化学反应方程式为2Ni2O3+4H2SO4=4NiSO4+O2↑+4H2O;
②控制pH为2~3的目的为抑制镍离子水解防止生成![]() 沉淀;
沉淀;
③向一定浓度的NiSO4溶液中加入适量的NaClO和NaOH混合液,制得碱性镍电池电极材料NiOOH,离子方程式为![]() ;
;
(3)浸出液A中含有大量的Ni2+、少量的H+和Fe3+,通入硫化氢时,Fe3+发生还原反应,H2S+2Fe3+=2Fe2++2H++S↓;
(4)A.在煅烧过程中,空气宜选择从下往上的通入方式,使镍红土矿燃烧更充分,A正确;
B.浓硫酸中的氢离子浓度较小,故加压酸浸中,为加快反应速率,不可选用浓硫酸,B错误;
C. 加压酸浸中,在最适宜条件下,浸出渣中的主要成份为SiO2和Fe2O3·H2O,C正确;
D. CO为无色无味的有毒气体,故从镍硫混合物到镍的过程中,需注意通风并及时检测操作过程中是否有CO泄露,D正确;
故选ACD。


科目:高中化学 来源: 题型:
【题目】常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( )

A.由题可知HA为弱酸
B.滴定终点不位于b和c点之间
C.滴定到b点时:n(Na+)+n(H+)-n(OH-)+n(HA)=0.002mol
D.滴定到d点时:c(OH-)>c(Na+)>c(A-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙癸醛是一种珍贵香料,广泛应用于香料、医药、染料及农药等行业。其合成路线如图所示(部分反应产物和反应条件已略去)。

回答下列问题:
(1)下列有关R和烯烃C3H6的说法正确的是__________________。(填代号)
A.它们的实验式相同 B.它们都能使溴水褪色
C.它们都能发生加成反应 D.它们都含有碳碳双键
(2)反应⑤的试剂和条件是___________________________;反应③的类型是_____________________。
(3)T所含官能团的名称是________;反应④的化学方程式为__________________________________。
(4)X的名称是____________________。
(5)遇氯化铁溶液发生显色反应的T的同分异构体有________种,其中,在核磁共振氢谱上有4组峰且峰面积比为1∶2∶3∶6的结构简式为_______________________________________________。
(6)参照上述流程图,以2—甲基—1,3—丁二烯为原料,经三步制备2—甲基—1,4—丁二醛,设计合成路线:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2L酒精中含有分子的数目为0.5NA
B.常温常压下,3.2g18O2的中子数目为2NA
C.常温常压下,24g镁与足量盐酸充分反应,转移的电子数为2NA
D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.22.4 L NO2中含有原子数为3 NA
B.1molNH3与1molNH![]() 所含电子数均为10NA
所含电子数均为10NA
C.14 g乙烯与丙烯的混合气体中所含碳原子数目为2NA
D.密闭容器中2 molSO2与1 mol O2在一定条件下充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作说法正确的是
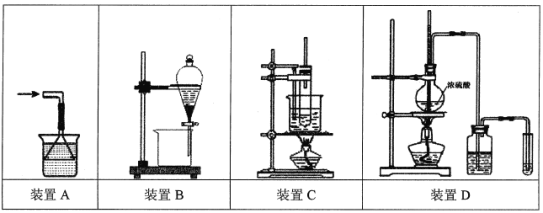
A.处理极易溶于水的气体尾气如NH3时,可选用装置A
B.萃取分离溴水中的Br2,可选用装置B,在萃取剂选择上可使用酒精、苯或CCl4
C.苯的硝化反应实验可选用装置C,反应前在试管中将1.5 mL浓HNO3和2 mL浓硫酸混合均匀,再快速倒入苯,防止其挥发
D.验证乙醇消去反应生成乙烯的实验可选用装置D,洗气瓶内需盛放NaOH溶液,反应开始时,加热烧瓶使混合液迅速上升到170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 mol ·L-1的Q后会发生如下反应:2Q(g) ![]() M(g) 。其中M的物质的量浓度随时间的变化如图所示。
M(g) 。其中M的物质的量浓度随时间的变化如图所示。
下列说法错误的是
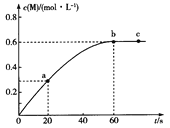
A.从反应开始到刚达到平衡时间段内,v(Q)=0.02 mol·L-1·s-1
B.a、b两时刻生成Q的速率:v(a)<v(b)
C.用Q浓度变化值表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0
D.其他条件相同,起始时将0. 2 mol·L-1氦气与Q混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂和反应条件已略去)。
(部分试剂和反应条件已略去)。
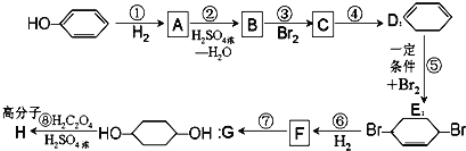
请回答下列问题:
(1)B,F的结构简式为:B__________,F_______________;
(2)反应①~⑦中属于消去反应的是(填代号)_______;
(3)根据反应![]() +Br2
+Br2![]()
![]() ,写出在同样条件下CH2=CHCH=CH2与等物质的量Br2发生加成反应的化学方程式:__________________;
,写出在同样条件下CH2=CHCH=CH2与等物质的量Br2发生加成反应的化学方程式:__________________;
(4)写出第④步C→![]() 的化学方程式(有机物写结构简式,注明反应条件)________;
的化学方程式(有机物写结构简式,注明反应条件)________;
(5)与4个不同的原子或原子团相连的碳原子称为手性碳原子;A~G这七种有机物分子中含有手性碳原子的是(填序号)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组发现有机化合物A的结构如图所示:
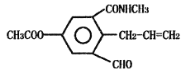
下列有关化合物A说法正确的是
A.化合物A的分子式为C14H13NO4
B.向化合物A中加入少量溴水,观察到溴水褪色,证明化合物A中含碳碳双键
C.1 mol化合物A最多可与3 mol NaOH溶液发生反应
D.化合物A可发生加成、氧化、缩聚、取代等反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com