



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��CH2=CH2+H2O
| |||
B��2CH3CH2OH+O2
| |||
C��nCH2=CH2
 | |||
D�� +3HNO3 +3HNO3
 +3H2O +3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����ͼ���仯�У�EΪ��ɫ��ζ��Һ�壨�����£���FΪ����ɫ�������ڿ�����ȼ�����ɵ���ɫ���壬GΪ��������ɫ���壨��Ӧ��������ʡ�ԣ����ش��������⣺
����ͼ���仯�У�EΪ��ɫ��ζ��Һ�壨�����£���FΪ����ɫ�������ڿ�����ȼ�����ɵ���ɫ���壬GΪ��������ɫ���壨��Ӧ��������ʡ�ԣ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | ���뷽��ʽ | ���볣�� K/mol?L-1 |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.26��10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?CO32-+H+ | K1=4.31��10-7 K2=5.61��10-11 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1��10-8 K2=1.1��10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52��10-3 K2=6.23��10-8 K3=2.20��10-13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1������Ҳ��һ�����ȼ�ϣ�������ȫȼ��ʱ��Ч�ʽ��Ͳ�������ж����������Ⱦ��
��1������Ҳ��һ�����ȼ�ϣ�������ȫȼ��ʱ��Ч�ʽ��Ͳ�������ж����������Ⱦ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
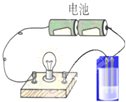 ����ͼ��ʾ��װ�÷ֱ��������ʵ�飬�����ӷ���ʽ��ȷ���������ʷ�Ӧ����Һ�ĵ����Աȷ�Ӧǰ������ǿ���ǣ�������
����ͼ��ʾ��װ�÷ֱ��������ʵ�飬�����ӷ���ʽ��ȷ���������ʷ�Ӧ����Һ�ĵ����Աȷ�Ӧǰ������ǿ���ǣ�������| A������������Һ��ͨ�������Ȼ��⣺Ag++Cl-�TAgCl�� |
| B������������Һ��ͨ��������H2SO3+Cl2+H2O�TSO42-+4H++2Cl- |
| C����FeI2��Һ��ͨ������������2Fe2++Cl2�T2Fe3++2Cl- |
| D����NaOH��Һ��ͨ������������2OH?+Cl2�TCl-+ClO-+H20 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com