
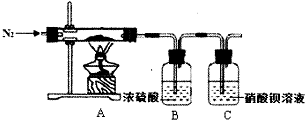
 硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.
硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.分析 (1)由于亚铁离子能被空气中的氧气氧化,样品要在隔绝空气条件下分解,所以实验前要通入N2可以将装置中的空气排尽,为使反应产生的气体充分被吸收,实验结束时还在通一会儿氮气,C中硝酸钡能氧化二氧化硫,生成硫酸钡和一氧化氮,据此答题;
(2)根据过滤操作可知,所用到的玻璃仪器有玻璃棒、烧杯、漏斗,硫酸钡沉淀在氯化钡沉淀中析出,可以通过检验沉淀表面是否有氯离子或钡离子判断沉淀是否洗净;
(3)滴定过程中亚铁离子被高锰酸钾氧化成铁离子,滴定终点时,溶液中出现紫红色;
(4)根据实验原理可知,根据步骤Ⅱ产生硫酸钡沉淀的质量可计算出硫酸根离子的物质的量,根据步骤Ⅲ用去的高锰酸钾的物质的量可计算出亚铁离子的物质的量,根据电荷守恒可确定铵根离子的物质的量,根据B装置的质量变化可知反应生成氨气和水的质量,进而确定水的物质的量,据此确定化学式.
解答 解:(1)由于亚铁离子能被空气中的氧气氧化,样品要在隔绝空气条件下分解,所以实验前要通入N2可以将装置中的空气排尽,为使反应产生的气体充分被吸收,实验结束时还在通一会儿氮气,C中硝酸钡能氧化二氧化硫,生成硫酸钡和一氧化氮,反应的离子方程式为3Ba2++3SO2+2NO3-+2H2O═3BaSO4↓+2NO↑+4H+,
故答案为:排尽装置中的空气,在隔绝空气条件下分解;将NH3、H20(g)全部赶入到装置B中;3Ba2++3SO2+2NO3-+2H2O═3BaSO4↓+2NO↑+4H+;
(2)根据过滤操作可知,所用到的玻璃仪器有玻璃棒、烧杯、漏斗,硫酸钡沉淀在氯化钡沉淀中析出,可以通过检验沉淀表面是否有氯离子或钡离子判断沉淀是否洗净,操作是:取最后一次洗涤液滤液适量于试管中,加入硫酸钠溶液(或硝酸酸化的硝酸银溶液),若无沉淀生成,则沉淀洗净,
故答案为:烧杯、漏斗;取最后一次洗涤液滤液适量于试管中,加入硫酸钠溶液(或硝酸酸化的硝酸银溶液),若无沉淀生成,则沉淀洗净;
(3)滴定过程中亚铁离子被高锰酸钾氧化成铁离子,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,判断滴定终点的现象是滴加最后一滴KMn04溶液时,溶液恰好呈紫红色,且半分钟内不再变化,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;滴加最后一滴KMn04溶液时,溶液恰好呈紫红色,且半分钟内不再变化;
(4)根据实验原理可知,称取ag晶体完全溶于水,加入过量BaCI2溶液,过滤、洗涤、干燥沉淀,称得沉淀质量为46.6g,根据硫酸根离子守恒,硫酸根离子的物质的量和硫酸钡的物质的量是相等的,即为:$\frac{46.6g}{233g/mol}$=0.2mol,称取a g晶体溶于水,配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L的KMn04酸性溶液滴定至终点,消耗KMn04溶液20.00mL,根据离子反应方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,可知样品中铁离子的物质的量为:5×0.1000mol/L×0.02L×10=0.1mol,根据电荷守恒可知铵根离子的物质的是为0.2mol×2-0.1mol×2=0.2mol,所以分解产生的氨气的物质的量也是0.2mol,根据B装置的质量变化可知反应生成氨气和水的质量,B装置在反应后增重14.2g,所以水的质量为14.2g-0.2×17g=10.8g,其物质的量为0.6mol,所以x:y:z=0.1:0.1:0.6=1:1:6,化学式为:FeSO4•(NH4)2SO4•6H2O,
故答案为:FeSO4•(NH4)2SO4•6H2O.
点评 本题涉及中和滴定、实验基本操作以及守恒法来确定物质的分子式等知识的综合考查题,要求学生具有分析和解决问题的能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 目的 |
| A | 取4gNaOH固体溶于100mL水中 | 配制0.1mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1-2mLFeCl3饱和溶液,搅拌并继续煮沸到变成红褐色 | 制备Fe(OH)3胶体 |
| C | 测定等物质的量浓度的盐酸、硝酸的pH | 比较Cl、N的非金属性 |
| D | 用MgCl2、AlCl3溶液做导电性试验 | 证明两者是离子化合物还是共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向50 mL 1 mol•L-1明矾溶液中滴入少量0.1 mol•L-1Ba(OH)2溶液Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| B. | 已知还原性Fe2+>Br-,a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4C1- | |
| C. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| D. | 在澄清石灰水中加入适量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质用途 | 解释 | |
| A | 食醋浸泡水壶中的水垢 | 水垢中CaCO3溶于醋酸,酸性H2CO3>CH3COOH |
| B | 炒菜时加一点酒和醋 | 有酯类物质生成,使菜味香可口 |
| C | NaClO溶液可用作洗手液 | NaClO具有杀菌、消毒作用 |
| D | Al2O3可用作医药中的胃酸中和剂 | Al2O3能与胃酸反应,使胃液酸度降低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
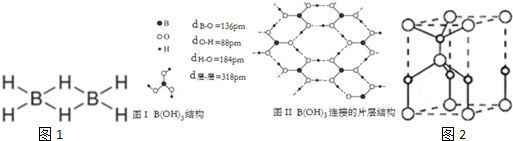
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com