
分析 (1)化石燃料燃烧生成二氧化硫、二氧化氮等酸性氧化物,这些物质溶于水后生成显酸性的物质,当雨水的PH<5.6时,形成酸雨;
(2)有利于环境保护就是对环境无污染,不能污染空气,不能污染水体,不能造成白色污染等方面;
(3)可以根据材料的分类及物质的组成进行分析,塑料,合成纤维,合成橡胶都是三大有机合成材料;
(4)垃圾的回收利用有保护环境的同时也节约了资源,根据不同的种类可以对垃圾进行分类回收.
解答 解:(1)因化石燃料燃烧生成二氧化硫、二氧化氮等酸性氧化物是形成酸雨的主要气体,
故答案为:C;
(2)含磷洗衣粉能使水体富营养化造成赤潮、水华现象发生;含铅汽油能污染空气;提倡使用太阳能,可以减少化石燃料的使用,减少污染物的产生;提倡个人使用大批量汽车,会消耗更多的燃料,产生污染物,
故答案为:D;
(3)塑料是有机合成材料,
故答案为:B;
(4)A.果皮果核最好填埋堆肥,不要焚烧焚烧处理,否则会造成污染,故A错误;
B.塑料制品可回收利用,故B错误;
C.铝质易拉罐属于废旧金属,应回收利用,故C正确;
D.旧衣服不易降解、腐烂,故不应该用堆肥法处理,故D错误.
故答案为:C.
点评 近几年来环保问题已经成为社会关注的焦点,保护环境,已刻不容缓.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 高温下,5.6gFe与足量水蒸气反应,转移的电子数为0.3NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 100g质量分数为17%的H2O2的水溶液中,极性共价键的数目为NA | |
| D. | 室温下向1L pH=1的醋酸溶液中加水稀释,所得溶液中的H+数目大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
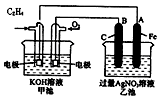 如图是一个化学过程的示意图,请根据该示意图完成下列题目:
如图是一个化学过程的示意图,请根据该示意图完成下列题目:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 纽扣式银锌电池的构造如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
纽扣式银锌电池的构造如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )| A. | Zn作正极 | B. | 电子经外电路流向Ag2O极 | ||
| C. | OH-向Zn极移动 | D. | 正极反应:Ag2O+H2O+2e-=2Ag+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焚烧废旧塑料以防止“白色污染” | |
| B. | 大量CO2排放可导致酸雨的形成 | |
| C. | 积极开发风力、太阳能发电,改善能源结构 | |
| D. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH)+c(HClO)═c(OH-)-c(H+) | |
| C. | 25℃时,0.10mol•L-1Na2CO3溶液通入CO2至溶液的pH=7时,溶液中:c(Na+)═c(CO32-)+c (HCO3-)+c(H2CO3) | |
| D. | 向0.1mol•L-1CH3COONa溶液中加入少量水,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)•c(O{H}^{-})}$ 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
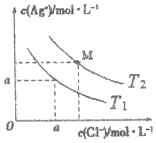 已知AgCl在水中的溶解是吸热过程.不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示.己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是( )
已知AgCl在水中的溶解是吸热过程.不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示.己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是( )| A. | T1>T2 | |
| B. | a=4.0×10-5 | |
| C. | M点溶液温度变为T1时,溶液中Cl-的浓度不变 | |
| D. | T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com