
【题目】塑料的使用大大方便了人类的生活,但由此也带来了严重的“白色污染”。下列对废弃塑料制品的处理方法中最为恰当的是( )。
A.焚烧
B.粉碎后深埋
C.倾倒在海洋中
D.用化学方法加工成防水涂料或汽油
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】高铁电池是一种可充电电池,其设计图如下所示:负极材料是Zn,氧化产物是Zn(OH)2,正极材料是K2FeO4(易溶盐),还原产物是Fe(OH)3,电解质溶液是KOH水溶液。下列有关说法正确的是
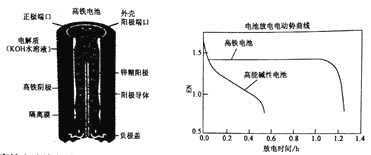
A. 高铁电池放电时正极反应为:Zn+2OH--2e-=Zn(OH)2
B. 高铁电池充电时阴极反应为Fe(OH)3+5OH--3e-=FeO42-+4H2O
C. 高铁电池放电时的总反应为:2FeO42-+8H2O+3Zn=2 Fe(OH)3+3 Zn(OH)2+4OH-
D. 高能碱性电池比高铁电池工作电压更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为____________。
(2)A与溴的四氯化碳溶液反应的化学方程式为________________________,反应类型是____________。
(3)已知: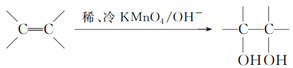 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的生成物的结构简式_______________。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的生成物的结构简式_______________。
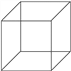
(4)与A互为同分异构体的一种物质为立方烷(见右图),该立方烷的二氯代物有__________________种。
(5)在一定条件下,由A聚合得到的高分子化合物的化学方程式为_________________________________________;反应类型为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数)( )
A. 在常温常压下,11.2 升氯气含有的分子数为0.5NA
B. 1 molFe与足量的Cl2反应转移的电子数为2NA
C. 常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D. 常温常压下,1 mol氦气含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)基态锌原子的价电子排布式是_____________。
(2)根据元素周期律,电负性Se______S,第一电离能Se________As(填“>”或“<”)。
(3)H2Se的分子构型是___________,其中Se的杂化轨道类型是___________。
(4)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
(5)晶体Zn为六方最密堆积,其配位数是_______________。
(6)在硒化锌ZnSe晶胞中,Se2—离子作面心立方最密堆积,且Se2—与Se2—之间的最短距离为a nm,则晶胞边长为_____________ nm。
(7)假设阿伏伽德罗常数值为NA,则144g 硒化锌ZnSe晶体中的晶胞数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下列实验探究金属铝与铜盐溶液反应:下列说法正确的是( )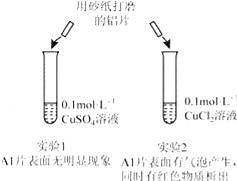
A. 由实验1 可以得出结论:金属铝的活泼性弱于金属铜
B. 实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu
C. 溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因
D. 由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2molL﹣1的盐酸和硫酸反应,后者更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干冰和二氧化硅晶体同属ⅣA族元素的最高价氧化物,它们的熔、沸点差别很大的原因是
A. 二氧化硅相对分子质量大于二氧化碳相对分子质量 B. C—O键键能比Si—O键键能小
C. 干冰为分子晶体,二氧化硅为原子晶体 D. 干冰易升华,二氧化硅不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合氢离子能力最强的是 ,根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:
① ② (填“>”“=”“<”下同)。溶液中阴离子的物质的量浓度之和:① ②。
(3)碳酸氢钠是一种 (填“强”或“弱”)电解质;写出HCO3-水解的离子方程式: ,常温下,0.1mol/L碳酸氢钠溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为: 。
(4)实验室中常用氢氧化钠来进行洗气和提纯。
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为: 。
② 几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)3]
Ksp[Mg(OH)2] (填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
( Ksp[Cu(OH)2]=2×10-20mol2/L2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com