
分析 先根据碳原子守恒计算四种有机物的物质的量,然后根据有机物和氯气的关系式计算总共消耗的氯气的物质的量.
解答 反应完全后,得四种有机物物质的量相等,根据碳原子守恒知,CH3Cl、CH2Cl2、CHCl3、CCl4的物质的量都是0.25mol,CH4与Cl2发生取代反应中消耗的氢原子和氯气分子的个数比是1:1;
生成0.25molCH3Cl需要Cl2的物质的量为0.25mol,
生成0.25molCH2Cl2需要Cl2的物质的量为0.25mol×2=0.5mol,
生成0.25molCHCl3需要Cl2的物质的量为0.25mol×3=0.75mol,
生成0.25molCCl4需要Cl2的物质的量为0.25mol×4=1mol,
所以总共消耗的氯气的物质的量n(Cl2)=(0.25+0.5+0.75+1)mol=2.5mol;
故答案为:2.5mol.
点评 本题考查了取代反应,明确取代反应中被取代的氢原子的物质的量与氯气分子的物质的量的关系是解本题的关键,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 对“地沟油”进行分馏可以获得汽油发动机的燃料 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 | |
| D. | 工业上氯气和澄清石灰水为原料制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:选择题
40℃时.在氮-水体系中不断通入CO2,各种离子的变化趋势如图所示。下列说法不正确的是

A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)。
C.随着CO2的通入,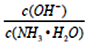 不断增大
不断增大
D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰晶体的密度小于液态水 | |
| B. | 实验测得水蒸气的摩尔质量大于18g/mol | |
| C. | 氯化氢极易溶于水,而甲烷难溶于水 | |
| D. | 邻羟基苯甲醛(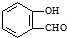 )沸点低于对羟基苯甲醛( )沸点低于对羟基苯甲醛(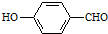 ) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烯烃与氢气加成得2,2-二甲基丁烷,该烯烃是2,2-二甲基-1-丁烯 | |
| B. | 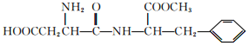 能发生水解反应,且与酸、碱均能反应 能发生水解反应,且与酸、碱均能反应 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 为检验某卤代烃中的卤素原子,应取少量卤代烃于试管中加入氢氧化钠溶液煮沸,冷却后加硝酸银溶液,然后根据卤化银沉淀的颜色确定卤素原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com