
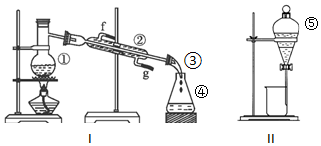
 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
| 现象 | B.一段时间后,出现白色沉淀 |
| C.一点时间后,无明显变化 |
分析 将NaCl与AgNO3溶液混合,产生白色沉淀为氯化银沉淀,向所得固液混合物中加Na2S溶液,沉淀变为黑色,滤出黑色沉淀,加入NaCl溶液,较长时间后,沉淀变为乳白色,O2 将Ag2S 氧化生成S时有Ag+游离出来,NaCl中大量的Cl-与游离的Ag+结合成,AgCl沉淀.由于c(Ag+)减小,有利于③中反应平衡右移,B中最终出现乳白色沉淀,
(1)将NaCl与AgNO3溶液混合发生复分解反应生成氯化银白色沉淀;
(2)向所得固液混合物中加Na2S溶液,会生成黑色沉淀,是因为硫化银溶解度小于氯化银,出现了沉淀转化;
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl.用浓HNO3溶解,产生红棕色气体,是浓硝酸被还原生成的二氧化氮,部分沉淀未溶解为氯化银,硝酸将硫元素氧化成硫酸根离子,则加入硝酸钡后生成硫酸钡沉淀;再结合步骤Ⅲ中黑色沉淀消失可知硫化银与空气中氧气反应生成硫单质,同时生成氯化银沉淀,过滤得到滤液X和白色沉淀Y为S;
①向X中滴加Ba(NO3)2溶液,产生白色沉淀为硫酸钡;
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀为S;
(4)①A中是二氧化锰催化作用使过氧化氢分解生成氧气;
②要探究生成氯化银和S沉淀的原因,C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,则B中应该为硫化银悬浊液;
③C中硫化银、氯化钠、氧气和水反应生成氯化银沉淀、S单质和NaOH,根据化合价变化相等配平,
解答 解:(1)将NaCl与AgNO3溶液混合发生复分解反应生成氯化银白色沉淀,Ⅰ中的白色沉淀是AgCl,
故答案为:AgCl;
(2)向所得固液混合物中加Na2S溶液,会生成黑色沉淀,是因为硫化银溶解度小于氯化银,出现了沉淀转化,Ⅱ中能说明沉淀变黑的离子方程式是:2AgCl(s)+S2-?Ag2S(s)+2Cl-,
故答案为:2AgCl(s)+S2-?Ag2S(s)+2Cl-;Ag2S比AgCl溶解度更小;
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl.用浓HNO3溶解,产生红棕色气体,是浓硝酸被还原生成的二氧化氮,部分沉淀未溶解为氯化银,则被氧化的只能为S元素,故乳白色沉淀为AgCl和S的混合物;其中S被稀硝酸氧化成硫酸根离子,则在步骤Ⅴ中向X中滴加Ba(NO3)2溶液会生成BaSO4沉淀,再结合步骤Ⅲ中黑色沉淀消失可知硫化银与空气中氧气反应生成硫单质,同时生成氯化银沉淀,过滤得到滤液X和白色沉淀Y为S,
①向X中滴加Ba(NO3)2溶液,产生白色沉淀为硫酸钡,由ⅰ判断,滤液X中被检出的离子是SO42-,故答案为:SO42-;
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀为S,故答案为:S;
(4)①装置A的作用是提供氧气,是二氧化锰催化过氧化氢分解生成的氧气和水,
故答案为:O2;
②进一步确认步骤Ⅲ中乳白色沉淀产生的原因,装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,则装置C中应该不含氯化钠溶液,即为Ag2S悬浊液,通过对比反应现象判断生成乳白色沉淀产生的原因,
故答案为:Ag2S悬浊液;
③装置C中生成的白色沉淀为氯化银和S单质,反应物应该还有氧气,产物中钠离子只能以NaOH形式存在,则未知的反应物为NaOH,再根据H元素守恒可知另一种未知反应物为水,然后根据化合价升降相等配平可得反应方程式:2Ag2S+4NaCl+O2+2H2O?4AgCl+2S+4NaOH;
故答案为:1,4NaCl,2;
点评 本题考查了性质实验方案的设计,题目难度较大,涉及难溶物溶度积的计算、氧化还原反应的配平、性质实验方案评价等知识,根据实验现象得出正确结论为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子的稳定性与分子间作用力的大小无关 | |
| B. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| C. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.2 | 0.6 |
| 1 | 0.9 | |
| 2 | 0.2 | |
| 4 | 0.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
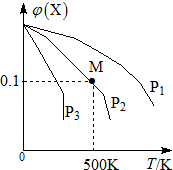 某可逆反应为2X(g)?3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示,下列推断正确的是( )
某可逆反应为2X(g)?3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示,下列推断正确的是( )| A. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ | |
| B. | 压强大小有P3>P2>P1 | |
| C. | 平衡后加入高效催化剂使气体相对分子质量增大 | |
| D. | 升高温度,该反应平衡常数K减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
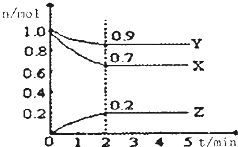 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的两随时间的变化曲线如图所示,据此回答:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的两随时间的变化曲线如图所示,据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com