
| A. | 241Am的中子数与电子数之差为146 | B. | 241Am与243Am的核外电子数相等 | ||
| C. | 241Am与243Am是同种核素 | D. | 241Am与243Am的化学性质不同 |
分析 A.元素符合左上角数字表示质量数、左下角数字表示质子数,中子数=质量数-质子数,原子中核外电子数=质子数,所以;
B.同位素核外电子数相等;
C.中子数不同、质子数相同的同一元素互称同位素,同位素是不同的核素;
D.同位素化学性质相同、物理性质不同.
解答 解:A.元素符合左上角数字表示质量数、左下角数字表示质子数,中子数=质量数-质子数,原子中核外电子数=质子数,所以241Am中质子数是95,质量数是241,中子数=241-95=146,核外电子数是95,则中子数与电子数之差为146-95=51,故A错误;
B.同位素核外电子数相等,这两种核外属于同位素,所以核外电子数相等,故B正确;
C.这两种核素质子数相同、中子数不同,所以互称同位素,属于不同的核素,故C错误;
D.同位素化学性质相同、物理性质不同,这两种核素互称同位素,所以化学性质相同,故D错误;
故选B.
点评 本题考查质子数、质量数、中子数、核外电子数及基本概念,属于基础题,明确这几个物理量之间的关系即可解答,注意:同位素原子核外电子数相同导致其化学性质相同,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 40μg/m3 | B. | 80μg/m3 | C. | 100μg/m3 | D. | 160μg/m3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
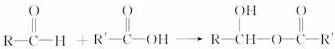
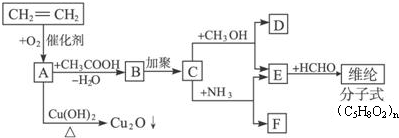
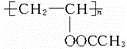 、FCH3CONH2.
、FCH3CONH2.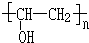 +nHCHO$\stackrel{一定条件}{→}$
+nHCHO$\stackrel{一定条件}{→}$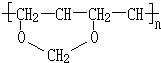 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
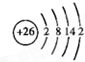 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,5.6 g Fe与足量水蒸气完全反应失去电子数为3×6.02×1022 | |
| B. | FeCl3溶液蒸干、灼烧至恒重,最终剩余固体是FeCl3 | |
| C. | 电解精炼铜时,阳极泥中常含有金属金、银、锌等 | |
| D. | 向0.1 mol•L-1 氨水中加少量水,pH减小,c(OH-)/c(NH3•H2O)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl是取代反应 | |
| B. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O是氧化反应 | |
| C. | 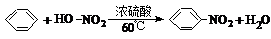 是取代反应 是取代反应 | |
| D. | 2RCH2OH+O2$→_{△}^{Cu}$2RCHO+2H2O是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
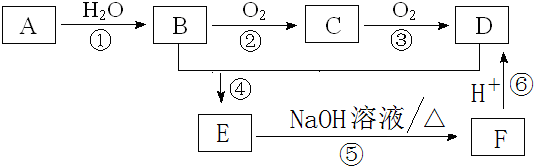
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不随时间改变 | B. | 容器内气体的压强不随时间改变 | ||
| C. | C的分解率不随时间改变 | D. | v(A):v(B):v(C)=m:n:p |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com