
| A. | 0.30 mol•L -1 | B. | 0.25mol•L -1 | C. | 0.50mol•L -1 | D. | 0.45mol•L -1 |
分析 根据n=cV计算K2SO4溶液和 Al2(SO4)3溶液中SO42- 的物质的量,混合后溶液中SO42- 的物质的量浓度等于SO42-的总物质的量除以溶液的总体积.
解答 解:100mL 0.3mol/L K2SO4溶液中SO42- 的物质的量为:0.1L×0.3mol/L=0.03moL,
100mL 0.2mol/L Al2(SO4)3溶液中SO42-的物质的量为:0.1L×0.2mol/L×3=0.06mol,
混合后溶液中SO42- 的总物质的量为:0.03moL+0.06mol=0.09mol,
溶液的总体积为:100ml+100ml=200ml,即0.2L,
所以混合后溶液中SO42- 的物质的量浓度为:$\frac{0.09mol}{0.2L}$=0.45mol/L,
故选D.
点评 本题考查物质的量浓度的计算,题目难度不大,注意对概念的理解与灵活应用.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Ag+、NO3-、Cl- | B. | Cu2+、Na+、SO42-、Cl- | ||
| C. | Ba2+、K+、NO3-、Cl- | D. | Zn2+、Na+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属晶体和离子晶体都能导电 | |
| B. | 在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用 | |
| C. | 金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 | |
| D. | 金属晶体和离子晶体中分别存在金属键和离子键等相互作用,很难断裂,因而都具有延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
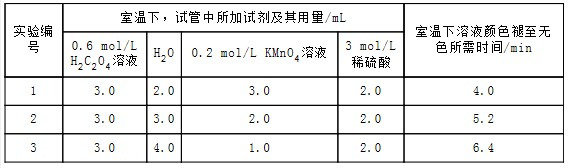
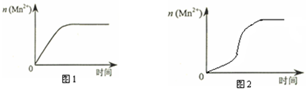
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙醇和乙酸发生酯化反应时断键② | |
| B. | 乙醇和金属钠的反应断键① | |
| C. | 乙醇和浓硫酸,共热到170℃时断键②⑤ | |
| D. | 乙醇在Cu催化作用下与O2反应时断键①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com