
【题目】某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图
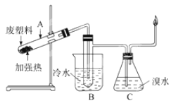
加热聚丙烯废塑料得到的产物如表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔:
![]()
写出反应(2)的化学方程式__________________________________。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有____种。
(3)经锥形瓶C中溴水充分吸收,剩余气体经过干燥后的平均相对分子质量为_______。
【答案】CaC2+2H2O→CH≡CH↑+Ca(OH)2 4 4.8
【解析】
(1)碳化钙和水反应制取乙炔,同时生成氢氧化钙;
(2)试管B中含有苯和甲苯,苯不能使高锰酸钾褪色,甲苯可以使高锰酸钾褪色;
(3)进入C中气体有:氢气、甲烷、乙烯、丙烯,烯烃与溴单质发生加成反应,剩余气体为甲烷和氢气,质量比为2:1,计算出物质的量之比,再计算出平均摩尔质量即可。
(1)反应②是碳化钙和水反应生成乙炔与氢氧化钙,反应方程式为:CaC2+2H2O→CH≡CH↑+Ca(OH)2,故答案为:CaC2+2H2O→CH≡CH↑+Ca(OH)2;
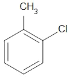
(2)试管B中含有苯和甲苯,苯不能使高锰酸钾褪色,甲苯可以使高锰酸钾褪色,一氯甲苯的同分异构体有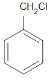 、
、 、
、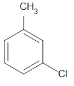 、
、 ,共有4种,故答案为:4;
,共有4种,故答案为:4;
(3)进入C中气体有:氢气、甲烷、乙烯、丙烯,烯烃与溴单质发生加成反应,使溴水褪色,经溴水充分吸收后剩余气体为甲烷和氢气,二者质量比为24%:12%=2:1,物质的量比为![]() :
:![]() =1:4,平均相对分子质量为:
=1:4,平均相对分子质量为:![]() =4.8,故答案为:4.8。
=4.8,故答案为:4.8。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将![]() 与足量NaOH醇溶液共热,同时发生了两种反应。能证明发生了消去反应的操作与现象是( )
与足量NaOH醇溶液共热,同时发生了两种反应。能证明发生了消去反应的操作与现象是( )
A.反应混合物![]() 溴的颜色褪去
溴的颜色褪去
B.反应混合物![]()
![]() 产生白色沉淀
产生白色沉淀
C.反应混合物![]() 有机物
有机物![]() 紫色褪去
紫色褪去
D.反应混合物![]() 有机物
有机物![]() 溴的颜色褪去
溴的颜色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S=Na2S2O3。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O35H2O于4045℃熔化,48℃分解:Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线 如图所示。

I.现按如下方法制备Na2S2O35H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按如下图示安装好装置。
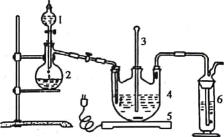
(1)仪器2的名称为__________,装置6中可加入________。
A. BaCl2溶液 B.浓 H2SO4 C.酸性KMnO4溶液 D. NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二 氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2═Na2SO3+CO2 ②Na2S+SO2+H2O═Na2SO3+H2S
③2H2S+SO2═3S↓+2H2O ④Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:______(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量:

(3)为减少产品的损失,操作①为_______,操作②是抽滤、洗涤、干燥,其中洗涤操作是用______(填试剂名称)作洗涤剂。
(4)蒸发浓缩滤液,直至溶液呈微黄色浑浊为止。蒸发时要控制温度不宜过高,其原因是_______________。
(5)制得的粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定杂质与酸性KMnO4溶液不反应)。 称取1.28g粗样品溶于水,用0.40mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液 中S2O32-全部被氧化时,消耗KMnO4溶液20.00mL。(5S2O32-+ 8MnO4-+14H+=8Mn2++l0SO42-+7H2O)
试回答:
①滴定终点时的颜色变化_______________。
②产品中Na2S2O35H2O的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组物质中:A.![]() 和
和![]() B.
B. ![]() 和
和![]() C.
C.![]() 和
和![]() D.
D. ![]() 和
和![]() E.
E. ![]() 和
和![]() 。其中__________互为同位素;___________是同分异构体;___________是同系物。
。其中__________互为同位素;___________是同分异构体;___________是同系物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有漂白性和较强的氧化性,下面是某实验小组设计的过氧化钠性质探究实验。回答下列问题:
探究Na2O2与H2反应:
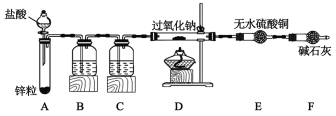
(1)装置B中所盛试剂的名称是___,其作用是___,为了简化实验,可用代替B和C装置___(填写装置名称和装置中所盛试剂的名称)。
(2)装入药品后,点燃D处酒精灯之前的操作是___。
(3)根据下表中的信息,完成对反应情况的探究。
步骤 | 现象 | 结论 |
点燃D处酒精灯 | D中Na2O2逐渐熔化,颜色由①___(填颜色变化),E处无明显现象。 | 加热条件下Na2O2与H2发生反应。 |
反应结束后,待D装置冷却后,取少量D中物质于试管中,加入适量水和几滴酚酞。 | ②___ | Na2O2反应后无剩余,Na2O2与H2反应的化学方程式为:③___。 |
探究Na2O2与水的反应:
(4)用脱脂棉包裹Na2O2粉末,然后滴几滴蒸馏水,发现脱脂棉燃烧起来,试分析其中的原因:___。
(5)有资料显示,Na2O2与水反应后的溶液中有H2O2,设计一个简单的实验证明H2O2的存在:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。则符合上述条件的烃A有几种(考虑顺反异构)
已知:
A. 3 B. 4 C. 6 D. 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
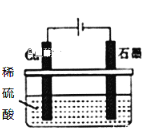
A. 碳酸的电离方程式:H2CO32H++CO32-
B. 碱性氢氧燃料电池负极的电极反应式:H2—2e-=2H+
C. 向FeBr2溶液中通入少量Cl2:2Br-+ Cl2= Br2+2Cl-
D. 如图所示,反应开始时的离子方程式:Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.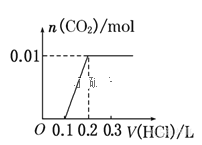 B.
B.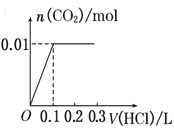
C.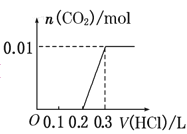 D.
D.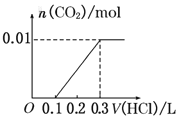
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com