
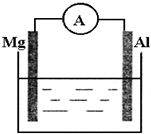
 如图所示装置
如图所示装置 分析 (1)若烧杯中溶液为稀硫酸,该装置符合原电池构成条件,所以能构成原电池,则电流表指针发生偏转,Mg易失电子作负极、Al作正极,负极反应式为Mg-2e-=Mg2+、正极反应式为2H++2e-=H2↑;
(2)若烧杯中溶液为氢氧化钠溶液,碱性条件下,Al易失电子作负极、Mg作正极,Al和NaOH、H2O反应生成NaAlO2、H2.
解答 解:(1)若烧杯中溶液为稀硫酸,该装置符合原电池构成条件,所以能构成原电池,则电流表指针发生偏转,Mg易失电子作负极、Al作正极,负极反应式为Mg-2e-=Mg2+、正极反应式为2H++2e-=H2↑,故答案为:Mg-2e-=Mg2+;2H++2e-=H2↑;
(2)若烧杯中溶液为氢氧化钠溶液,碱性条件下,Al易失电子作负极、Mg作正极,负极反应式为Al+4OH--3e-═AlO2-+2H2O,正极反应式为2H2O+2e-=H2↑+2OH-,总反应的离子方程为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Al;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 电极反应式的书写要注意结合电解质溶液酸碱性、物质的性质,不能根据金属的活泼性强弱判断正负极,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
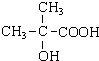 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>B>D | C. | A>C>D>B | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )
甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙与庚的原子核外电子数相差14 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com