
| A. | 原子半径:W>Z>Y>X | |
| B. | W单质易溶于化合物YW2 | |
| C. | 氢化物的稳定性和沸点均是Z>W | |
| D. | X单质在加热的条件下与Z的某种单质反应生成X2Z2 |
分析 短周期元素X、Y、Z和W的原子序数依次增大,元素X是一种最轻的金属,则X为Li元素;在中学范围内Z的单质只有氧化性,且是空气的主要成分之一,则Z为O元素;Y原子的最外层电子数是其电子层数的2倍,而且原子序数比O小,则其电子排布为2、4,所以Y为C元素;W的氢化物能与O的某种氢化物反应生成O的另外一种氢化物和W单质,则反应为:H2O2+H2S=S↓+2H2O,所以W为S元素,据此分析.
解答 解:短周期元素X、Y、Z和W的原子序数依次增大,元素X是一种最轻的金属,则X为Li元素;在中学范围内Z的单质只有氧化性,且是空气的主要成分之一,则Z为O元素;Y原子的最外层电子数是其电子层数的2倍,而且原子序数比O小,则其电子排布为2、4,所以Y为C元素;W的氢化物能与O的某种氢化物反应生成O的另外一种氢化物和W单质,则反应为:H2O2+H2S=S+2H2O,所以W为S元素;
A.同一周期从左到右原子半径依次增大,电子层数越多半径越大,则原子半径:S>Li>C>O,即W>X>Y>Z,故A错误;
B.S单质易溶于化合物CS2,故B正确;
C.同主族从上到下,氢化物的稳定性增强,则氢化物的稳定性:H2O>H2S,由于水分子间存在氢键沸点较高,所以沸点:H2O>H2S,故C正确;
D.Li在氧气中燃烧只生成氧化物,即Li2O,故D错误.
故选BC.
点评 本题考查原子结构与元素周期律的关系,题目侧重于原子结构与元素周期律的递变规律的考查,注意根据原子结构特点明确元素的种类为解答该题的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
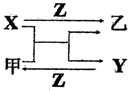 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )| A. | X、Y、Z一定都是非金属单质 | B. | X、Y、Z一定都是金属单质 | ||
| C. | X、Y、Z中至少有一种是非金属单质 | D. | X、Y、Z中至少有一种是金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序是Z>W>Y>X | |
| B. | 元素的非金属性W>Y>X | |
| C. | Z2Y3、WX分别是离子化合物、共价化合物 | |
| D. | X、Z、W的最高价氧化物都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取、过滤、蒸馏、蒸馏 | B. | 过滤、分液、蒸馏、萃取 | ||
| C. | 过滤、蒸馏、过滤、蒸馏 | D. | 过滤、分液、过滤、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元素 | Mn | Fe | |
| 电离能 KJ/mol | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
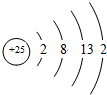 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物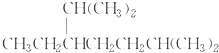 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 乙烯和聚乙烯二者都能使溴的四氯化碳溶液褪色 | |
| C. | 化合物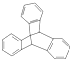 是苯的同系物 是苯的同系物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 111 | B. | 161 | C. | 272 | D. | 433 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
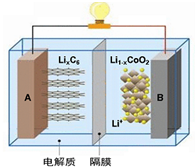 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 充电时Li+从右边流向左边 | |
| B. | 放电时,正极锂的化合价未发生改变 | |
| C. | 充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com