

 ��CO������Ϊ���к���������HCl��
��CO������Ϊ���к���������HCl������ ��1��������ϩ�ڸ����·����ֽ⡢����ȫȼ�շ�Ӧ�����ݷ�Ӧ��֪��C-C������C=C����ӦΪ��ȥ��Ӧ�����ݱ���CO������ˮ�����ʣ�����ʪë����ڱǣ�
��2��CH2=CH2�������������ӳɷ�Ӧ����CH2Cl-CH2Cl��CH2Cl-CH2Cl������ȥ��Ӧ����CH2=CHCl��CH2=CHCl�����Ӿ۷�Ӧ������PVC��
��� �⣺��1��������ϩ�ڸ����·����ֽ⡢����ȫȼ�շ�Ӧ����������к�����ΪHCl�� ��CO��������ϩ��Cl�ĺ����ϸߣ������ɵ�HClӦ��࣬
��CO��������ϩ��Cl�ĺ����ϸߣ������ɵ�HClӦ��࣬
�ʴ�Ϊ��HCl�� ��CO�� HCl��
��CO�� HCl��
��2��CH2=CH2�������������ӳɷ�Ӧ����CH2Cl-CH2Cl��CH2Cl-CH2Cl������ȥ��Ӧ����CH2=CHCl��CH2=CHCl�����Ӿ۷�Ӧ������PVC�����ΪCH2Cl-CH2Cl����ΪCH2=CHCl����Ӧ�ڵĻ�ѧ����ʽΪCH2Cl-CH2Cl $\stackrel{һ������}{��}$CH2=CHCl+HCl��
�ʴ�Ϊ��CH2Cl-CH2Cl $\stackrel{һ������}{��}$CH2=CHCl+HCl��
���� ���⿼���л���ĺϳɼ��ƶϣ���Ŀ�Ѷ��еȣ������Ĺؼ����ܰ����л�������ŵı仯����������Ϣ���н��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
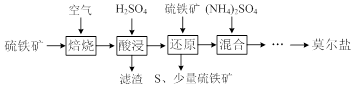
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��15��Ԫ��ԭ�ӵ����������Ų�Ϊns2 np5 | |
| B�� | ֻ�еڶ��е�Ԫ��ԭ�����������Ų�Ϊns2 | |
| C�� | �������ڵ�9��Ԫ������Ԫ�� | |
| D�� | ��9����Ԫ����û�зǽ���Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������NaOH��Һ��Al+4OH-=[Al��OH��4]- | |
| B�� | ��AlCl3��Һ�м���������ˮ�Ʊ�Al��OH��3��Al3++3OH-=Al��OH��3�� | |
| C�� | Na2SiO3��Һ��ͨ�����CO2��CO2+H2O+SiO32-=H2SiO3��+CO32- | |
| D�� | ��Na[Al��OH��4]��Һ�м�����������[Al��OH��4]-+4H+=Al3++4H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com