
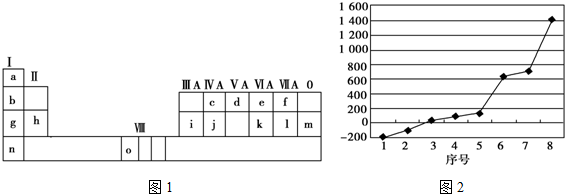
分析 (1)元素O属于第四周期第ⅤⅢ族,为Fe元素;
(2)d属于第二周期第ⅤA族,为N元素,其氢化物为NH3;K属于第三周期第ⅥA族,为S元素;
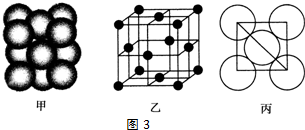
(3)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大,熔沸点为原子晶体>金属晶体>分子晶体,分子晶体有氩、氯气、S、磷,在分子晶体中Ar只有分子间作用力,沸点最低,氯气、S、磷中只有氯气为气体,其熔沸点在三者中最小;
(4)①i为第二周期第ⅢA族,为Al元素,①根据图甲可知,该类型为面心立方最密堆积,配位数=3×$\frac{1}{2}$×8=12;
②根据晶胞密度$ρ=\frac{m}{V}$计算.
解答 解:(1)从图中看出元素O属于第四周期第ⅤⅢ族,为Fe元素,基态原子外围电子排布式为3d64s2,故答案为:3d64s2;
(2)d的氢化物为NH3,中心原子N电子对数为$\frac{5+1×3}{2}$=4,为sp3杂化方式,有一对孤电子对,分子构型为三角锥形.k为S元素,在空气中燃烧产物为SO2,中心原子S电子对数为$\frac{6+0}{2}$=3,为sp2杂化方式,有一对孤电子对,分子构型为V形,故为极性分子,
故答案为:三角锥形;sp3;V形;sp2;极性;
(3)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大,由图可知序号“8”代表的为Si,分子晶体的沸点较低,非金属性越强的电负性越大,分子晶体有氩、氯气、S、磷,在分子晶体中Ar只有分子间作用力,沸点最低,氯气、S、磷中只有氯气为气体,其熔沸点在三者中最小,由图可知,序号“2”代表的为Cl,其电负性最大,
故答案为:Si;2;
(4)i为第二周期第ⅢA族,为Al元素,
①根据图片知,Al单质为面心立方最密堆积,Al原子配位数配位数=3×$\frac{1}{2}$×8=12,由图2可知占据顶点和面心,则个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
故答案为:12;4.
②一个晶胞中原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,一个晶胞的质量m=$\frac{4M}{{N}_{A}}$,晶胞体积V=$(\frac{4d}{\sqrt{2}})^{3}$,密度$ρ=\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{(\frac{4d}{\sqrt{2}})^{3}}$=$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$,
故答案为:$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及元素周期表、核外电子排布、杂化轨道、分子结构等,难度中等,注意把握元素在周期表中的位置、元素的性质等,侧重于元素周期表和周期律知识的综合应用的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率大于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O3与SO2的结构相似 | B. | 硫粉不溶于水,易溶于CS2中 | ||
| C. | Be(OH)2是两性氢氧化物 | D. | 在相同条件下,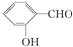 的沸点高于 的沸点高于 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2和18O3互为同位素 | |
| B. | O2和O3的相互转化是物理变化 | |
| C. | 等物质的量的O2和O3含有相同的质子数 | |
| D. | 等质量的O2和O3含有相同的O原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 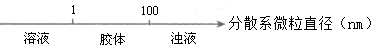 分散系的分类 | |
| B. | 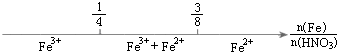 铁与稀硝酸反应后溶液中铁元素的存在形式 | |
| C. | 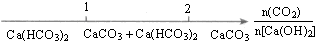 CO2通入澄清石灰水中反应的产物 | |
| D. | 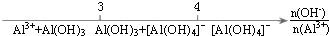 AlCl3溶液中滴加NaOH溶液后Al元素的存在形式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com