
【题目】对废弃物的再利用,不仅能够减少污染,还能有效的节约资源,实现“变废为宝”。为实现某合金废料的再利用,设计流程如下:
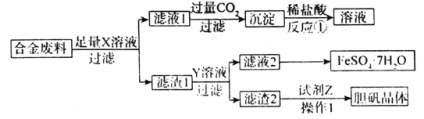
下列叙述错误的是
A.从合金废料回收的金属元素有Al、Fe、Cu
B.X可能是NaOH或H2SO4
C.操作1包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.滤渣1一定含有Fe和Cu
【答案】B
【解析】
由流程图可知,合金溶解后的滤液1与过量的二氧化碳反应生成沉淀,该沉淀溶于盐酸,可知沉淀为Al(OH)3,滤渣1与溶液Y反应后,滤液2蒸发浓缩、冷却结晶得到硫酸亚铁晶体,滤渣2可以得到胆矾,可知试剂X为NaOH,Y为稀硫酸,Z为浓硫酸或氧气和稀硫酸,因此合金中含Cu、Fe和Al,由此作答。
A. 由分析可知合金中含Cu、Fe和Al三种元素,因此从合金废料回收的金属元素有Al、Fe、Cu,A项正确,不符合题意;
B. 由分析可知试剂X为NaOH,B项错误,符合题意;
C. 滤渣2可以得到胆矾,操作1包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥,C项正确,不符合题意;
D. 合金废料中的金属元素有Al、Fe、Cu,加入氢氧化钠溶液后Al可完全溶解,因此滤渣1中含Fe和Cu,D项正确,不符合题意;
答案选B。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C为中学化学中常见的单质,在室温下A为固体,B和C为气体,向D溶液中加入KSCN溶液后,溶液显红色。在适宜的条件下可发生如下转化:
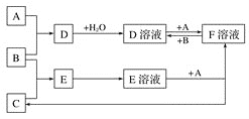
试回答下列问题:
(1)写出A、B、C的化学式:A_____、B_______、C_________。
(2)反应E溶液+A→F溶液+C的离子方程式为:______________ ; D溶液+A→F溶液的离子方程式为:___________;若向F溶液中加入NaOH溶液,观察到的现象为:_________。
(3)写出除去D溶液中F杂质的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.H2O2(l)=![]() O2(g)+H2O(l) △H=-98kJ/mol,该反应在任何温度下均能自发进行
O2(g)+H2O(l) △H=-98kJ/mol,该反应在任何温度下均能自发进行
B.将0.1mol/L的NH3·H2O溶液加水稀释,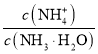 值增大
值增大
C.对于可逆反应,化学平衡向正反应方向移动,则平衡常数一定增大,反应物的转化率增大
D.pH=6的溶液可能呈酸性,因为升高温度,水的离子积Kw增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料产业是21 世纪各国竞相发展的高科技支柱产业之一,碳酸锰(MnCO3)可制造电信器材的软磁铁氧体。工业上利用软锰矿(主要成分为 MnO2,含少量SiO2、Fe2O3、CuO 等杂质)和含SO2的烟气为主要原料制备无水碳酸锰的工艺流程如下:

已知:①MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃ 时开始分解。
②不同金属离子生成氢氧化物沉淀的 pH 和有关物质的 Ksp 如下表:
离子 | Fe3+ | Fe2+ | Cu2+ | Mg2+ | ||||
开始沉淀的pH | 2.7 | 7.5 | 4.2 | 7.8 | ||||
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 9.8 | ||||
物质 | MnS | CaF2 | CuS | |||||
Ksp | 2.5×10-13 | 1.5×10-10 | 1.3×10-36 | |||||
回答下列问题:
(1)为提高“溶浸”过程中的浸取速率,以下方法不能提高浸取速率的是________。
A.将矿石研磨粉碎 B.连续搅拌 C.延长浸取时间 D.升高温度 E.适当增大稀硫酸的浓度
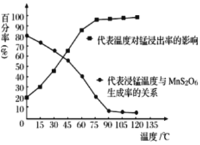
“溶浸”过程中往往有副产物MnS2O6 生成,温度对“溶浸”反应的影响如下图所示, 为减少MnS2O6的生成,“溶浸”的适宜温度应大于___。
(2)“除铁”步骤中,在加入石灰调节溶液的pH前,加入适量的软锰矿,发生反应的离子方程为____。
(3) “净化”步骤的目的是除去溶液中的Ca2+、Cu2+等杂质。若测得滤液中 c(F-)=0.02molL-1,则滤液中残留的c(Ca2+) =__。
(4) “沉锰”步骤中 ,加入 NH4HCO3后有无色无味的气体放出, 发生反应的离子方程式为______。
(5)从“沉锰”步骤中要得到纯净无水MnCO3,先将析出的 MnCO3沉淀过滤,再用_______(填化学式)洗涤更易于干燥。过滤后废液的主要成分为____(填化学式)。
(6)实际生产中, 运用阴离子交换膜法电解得到金属锰,电解装置如下图所示,B电极为直流电源的_________极。该工艺若不使用离子交换膜, 会造成Mn2+发生副反应生成 MnO2, 写出该副反应的电极反应式_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前Haber-Bosch法是工业合成氨的主要方式,其生产条件需要高温高压。为了有效降低能耗,过渡金属催化还原氮气合成氨被认为是具有巨大前景的替代方法。催化过程一般有吸附—解离—反应—脱附等过程,图示为N2和H2在固体催化剂表面合成氨反应路径的势能面图(部分数据略),其中“*”表示被催化剂吸附。
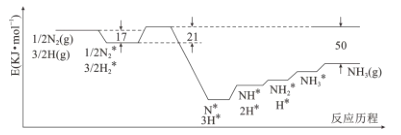
(1)氨气的脱附是____过程(填“吸热”或“放热”),合成氨的热化学方程式为_____
(2)合成氨的捷姆金和佩热夫速率方程式为 w= k1 p(N2)![]() -k2
-k2![]() ,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H22NH3的平衡常数Kp=_________(用k1,k2表示)(注:Kp用各物质平衡分压来表示)。
,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H22NH3的平衡常数Kp=_________(用k1,k2表示)(注:Kp用各物质平衡分压来表示)。
(3)若将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2温度下n(H2)的变化,曲线B表示T1温度下n(NH3)的变化,T2温度下反应到a点恰好达到平衡。
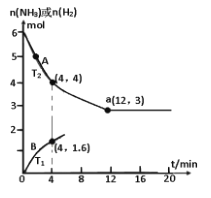
①温度T1___T2 (填“>”、“<”或“=”下同),T1温度下恰好平衡时,曲线B上的点为b(m, n ),则m___12,n__2。
②T2 温度下,反应从开始到恰好平衡时平均速率v(N2) =_____。
③T2温度下,合成氨反应N2+3H22NH3的平衡常数的数值是____;若某时刻,容器内气体的压强为起始时的80%,则此时v(正)____v(逆)(填“>”、“<”或“=”)。
(4)工业上通过降低反应后混合气体的温度而使氨气分离出来。这种分离物质的方法, 其原理类似于下列方法中的___(填序号)。
A.过滤 B.蒸馏 C.渗析 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用KClO3与浓盐酸反应制取氯气的简易装置。下列说法正确的是
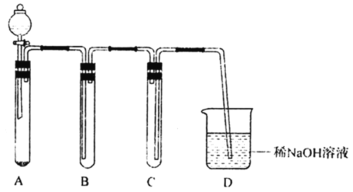
A.A中固体也可以用高锰酸钾、重铬酸钾、二氧化锰等代替
B.装置A发生反应的方程式为KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
C.待没有气泡产生后,向A中加入足量AgNO3,根据沉淀质量可求出剩余盐酸的量
D.装置B盛放的是饱和食盐水,目的为除去HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,正确的是( )
A.戊烷有2种同分异构体
B.C8H10中只有3种属于芳香烃的同分异构体
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.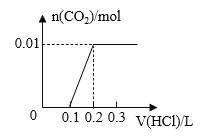 B.
B.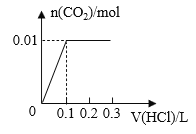
C.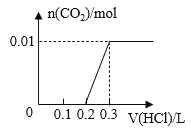 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.32 g S8与S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
B.1 L 0.1 mol·L-1 H2C2O4溶液中含C2O![]() 离子数为0.1NA
离子数为0.1NA
C.2 mol NO与2 mol O2在密闭容器中充分反应,转移的电子数为8NA
D.56g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com