
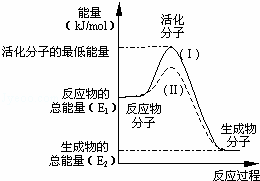
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol﹣1表示.请认真观察下图,然后回答问题.
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)提供能量,该反应的△H= (用含E1、E2的代数式表示).
(2)已知热化学方程式:H2(g)+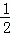 O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 .
考点: 反应热和焓变.
专题: 化学反应中的能量变化.
分析: (1)依据图 象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量﹣反应物的能量;
象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量﹣反应物的能量;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;
(3)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,结合影响所以速率的元素分析判断;
解答: 解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量﹣反应物的能量;△H=E2﹣E1;故答案为:放热,需要,E2﹣E1 ;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;H2(g)+ O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol;故答案为:409.0KJ/mol;
O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol;故答案为:409.0KJ/mol;
(3)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂;故答案为:最有可能使用了催化剂;
点评: 本题考查了化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算,图象的综合应用,读懂图象,焓变和活化能计算方法的理解是胶体关键.


科目:高中化学 来源: 题型:
关于下列各实验装置的叙述中,不正确的是()
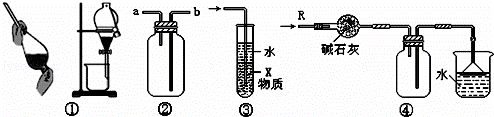
A. 装置①可用于分离C2H5OH和H2O的混合物
B. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了变废为宝,拟采用铅铬黄法对某电镀厂含铬废水进行处理,并生产出符合条件的铅铬黄(PbCrO4).设计实验如下:
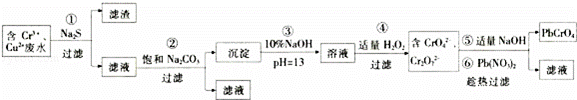
已知:a.该厂的废水中主要含Cr3+,还有少量Cu2+和其它可溶性杂质;
b.Cr(OH)3不溶于水,具有两性,pH=13时,发生反应:Cr(OH3)+OH﹣=﹣
回答下列问题:
(1)滤渣的成分是 (填化学式);第②步加入Na2CO3溶液的作用是 .
(2)第④步生成CrO42﹣的离子方程式为 .
(3)第⑤步加入NaOH的目的是为了提高铅铬黄的产率,请用化学平衡移动原理加以解释: .
(4)测定铅铬黄纯度:取mg铅铬黄样品溶解,加足量KI将其还原为Cr3+,再用 c mol•L﹣1 Na2S2O3标准液滴定(反应:2Na2S2O3+I2=Na2S4O6+2NaI),消耗体积VmL.该滴定实验中所需主要玻璃仪器有烧杯、 ,测定标准液体积的仪器事先进行洗涤所用试剂依次为 ;此铅铬黄样品的质量分数w=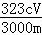 (用含c、m和V的式子表示).
(用含c、m和V的式子表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
已知葡萄糖(C6H12O6)的燃烧热是2804kJ•mol﹣1,当它被氧化生成1mol水时放出的热量是()
A. 26.0kJ B. 5 1.9kJ C. 155.8kJ D. 467.3kJ
1.9kJ C. 155.8kJ D. 467.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,浓度都是1mol•L﹣1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为c(X2)=0.6mol•L﹣1,c(Y2)=0.8mol•L﹣1,c(Z)=0.4mol•L﹣1,则该反应的反应式可表示为()
A. X2+2Y2═2XY2 B. 2X2+Y2═2X2Y C. 3X2+Y2═2X3Y D. X2+3Y2═2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 需要加热方能发生的反应一定是吸热反应
B. 若反应为放热反应,则该反应不必加热就可发生
C. 放热反应比吸热反应容易发生
D. 化学反应总是伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H﹣H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,根据热化学方程式H2(g)+ O2(g)═H2O(l)△H=﹣286kJ/mol,判断H2O分子中O﹣H键的键能为()
O2(g)═H2O(l)△H=﹣286kJ/mol,判断H2O分子中O﹣H键的键能为()
A. 485.5 kJ/mol B. 610 kJ/mol C. 917 kJ/mol D. 1 220 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在微生物作用下,NH4+经过两步反应被氧化成NO3﹣.反应的能量变化示意图如下:
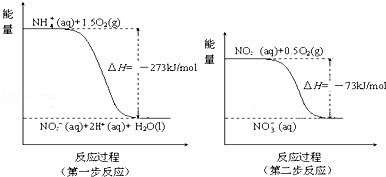
①第一步反应是 反应(选填“放热”或“吸热”),判断依据是 .
②1mol NH4+(aq)全部氧化成NO3﹣(aq)的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g) 正反应是放热反应.若反应物起始的物质的量相等,下列关于该反应的示意图不正确的是()
A. 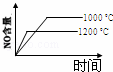 B.
B. 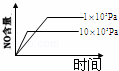 C.
C. 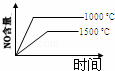 D.
D. 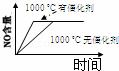
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com