
【题目】四种短周期元素在周期表中的相对位置如下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
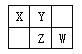
请回答下列问题:
(1)元素Z位于周期表中的位置_____________________。
(2)X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱依次为________________(写化学式)。
(3)X和Y形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,该化合物的分子式为__________,该分子中各原子最外层均满足8电子稳定结构,其结构式为 ___________.
(4)写出W的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式_____________,
反应中若转移12mol电子,消耗的还原剂质量为______g。
【答案】 第三周期第ⅤA族 HNO3> H3PO4> H2CO3 C2N2或N2C2 N≡C—C≡N C + 2H2SO4(浓)![]() CO2↑+2SO2↑ + 2H2O 36g
CO2↑+2SO2↑ + 2H2O 36g
【解析】首先利用Z的核外电子排布特点判断出Z,进而结合元素在周期表中的位置判断其余元素,最后依据元素周期律和相关物质的性质分析解答。
短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,Z位于第三周期,则(2+8+x)=3x,解得x=5,则Z为P;然后由元素周期表中的位置可知,X为C,Y为N,W为S,则(1)Z为P,原子结构中有3个电子层,最外层电子数为5,则位于元素周期表中的第三周期,第VA族;(2)非金属性S>P>C,非金属性越强,最高价含氧酸的酸性越强,因此酸性强弱顺序是HNO3> H3PO4> H2CO3;(3)C和N形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,所以分子中碳原子个数介于![]() 和
和![]() ,因此该化合物的分子中碳原子个数2,则相对分子质量是
,因此该化合物的分子中碳原子个数2,则相对分子质量是![]() ,所以氮原子个数是
,所以氮原子个数是![]() ,则分子式为C2N2或N2C2,该分子中各原子最外层均满足8电子稳定结构,所以其结构式为N≡C—C≡N;(4)碳和浓硫酸在加热条件下反应的方程式为C + 2H2SO4(浓)
,则分子式为C2N2或N2C2,该分子中各原子最外层均满足8电子稳定结构,所以其结构式为N≡C—C≡N;(4)碳和浓硫酸在加热条件下反应的方程式为C + 2H2SO4(浓)![]() CO2↑+2SO2↑ + 2H2O;碳元素化合价从0价升高到+4价,失去4个电子,因此每转移12mol电子,消耗3mol碳,质量是36g。
CO2↑+2SO2↑ + 2H2O;碳元素化合价从0价升高到+4价,失去4个电子,因此每转移12mol电子,消耗3mol碳,质量是36g。


科目:高中化学 来源: 题型:
【题目】向盛有50 mL 1.00 mol·L1 盐酸的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列说法不正确的是

A.该实验表明化学能可以转化为热能
B.NaOH溶液的浓度大于1.00 mol·L1
C.V=50 mL时,混合溶液的pH>7
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17.下列说法正确的是 ( )
A. X、Y、Z既能形成离子化合物,又能形成共价化合物
B. 元素的原子半径由小到大的顺序为r(Y)<r(Z)
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有4种
D. H2Z的熔点比H2W高,是因为H2Z分子内存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。参照元素在表中的位置,请用化学用语回答下列问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)⑨的最高价含氧酸的化学式为_________。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为_________。
(3)③④⑦⑧的简单离予半径由大到小的顺序为_________。(用离子符号表示)
(4)②④的最高价氧化物的水化物之间发生反应的离予方程式_________。
(5)用电子式表示③和⑨组成的化介物的形成过程_________。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子。在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是

A.海水pH约为8的原因主要是天然海水含CO32-、HCO3-
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42-
D.经稀释“排放”出的废水中,SO42-浓度与海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比![]() 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________(填“变浅”“变深”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是( )
A. 地壳中金属元素的含量 B. 金属的延展性
C. 金属的导电性 D. 金属冶炼的难易程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不能为( )
A. n+8 B. n+18 C. n+20 D. n+32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②加入足量碘水溶液 ③加入少量KSCN溶液
A. ①③ B. ③② C. ③① D. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com