
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有3个电子。
(1)C原子的基态电子排布式为__________;若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式分类,A与C形成的最简单化合物中的共价键属于__________键。
(2)当n=2时,元素A在周期表中的位置是__________,B与C形成的化合物的VSEPR模型名称为__________形。
(3)当n=3时,B与C形成的晶体类型是__________,此时A、B、C、D四种元素的第一电离能由大到小的顺序是__________(用元素符号表示)。
【答案】(1)1s22s22p4; 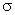 键;(2)第二周期第ⅠA族 直线 (3)原子晶体 O>P>Si>Na。
键;(2)第二周期第ⅠA族 直线 (3)原子晶体 O>P>Si>Na。
【解析】
试题分析:(1)由于C元素是短周期元素,原子的最外层电子数是其电子层数的3倍,则C是O元素,其基态电子排布式为1s22s22p4;若A元素的原子最外层电子排布为1s1,则A是H元素,A与C形成的最简单化合物H2O中的共价键属于极性共价键;按原子轨道的重叠方式分类应该属于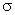 键;(2)当n=2时,元素A是Li,在周期表中的位置是第二周期第ⅠA族;由于 B元素的原子价电子排布为ns2np2,则B是C元素;B与C形成的化合物CO2的VSEPR模型名称为直线型;(3)当n=3时,由于 B元素的原子价电子排布为ns2np2,则B是Si元素;B与C形成的晶体是SiO2;晶体类型是原子晶体;D元素原子的M电子层的p能级中有3个电子,则D是P元素。元素的非金属性越强,其第一电离能就越大。同一周期的元素,原子序数越大,元素的第一电离能就越大;由于此时A、B、C、D四种元素分别是Na、Si、O、P的第一电离能由大到小的顺序是 O>P>Si>Na。
键;(2)当n=2时,元素A是Li,在周期表中的位置是第二周期第ⅠA族;由于 B元素的原子价电子排布为ns2np2,则B是C元素;B与C形成的化合物CO2的VSEPR模型名称为直线型;(3)当n=3时,由于 B元素的原子价电子排布为ns2np2,则B是Si元素;B与C形成的晶体是SiO2;晶体类型是原子晶体;D元素原子的M电子层的p能级中有3个电子,则D是P元素。元素的非金属性越强,其第一电离能就越大。同一周期的元素,原子序数越大,元素的第一电离能就越大;由于此时A、B、C、D四种元素分别是Na、Si、O、P的第一电离能由大到小的顺序是 O>P>Si>Na。
考点:考查元素的推断、元素在周期表中的位置、分子结构、晶体结构及化学键的类型、电离能的比较。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
对于给定的可逆反应的平衡常数(K)的说法正确的是
A.K只与温度有关,温度不变,K不变
B.改变条件,反应物的转化率增大,K也一定增大
C.温度一定时,其正、逆反应的K相等
D.若正反应ΔH<0,升高温度,该反应的K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
2.3 g纯净金属钠在干燥空气中被氧化后得到3.5 g固体,由此可判断其氧化物是
A.只有Na2O B.只有Na2O2 C.Na2O和Na2O2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,将等质量的AgCl固体分别加入到等体积的下列4种溶液中,AgCl溶解最少的是
A.1 mol/L的AlCl3溶液 B.2mol/L的NaCl溶液
C.1.4mol/L的BaCl2溶液 D.1mol/L的MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,酸性由强到弱的排列顺序错误的是
A.HClO H2CO3 CH3COOH B.HClO4 HClO3 HClO2
C.HClO4 H2SO4 H3PO4 D.HClO4 HBrO4 HIO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的描述中正确的是( )
A 葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体
B 利用蛋白质的颜色反应可以鉴别所有的蛋白质
C 多糖、蛋白质、脂肪和聚丙烯等都属于高分子化合物
D 食醋中的主要成分为乙酸,普通食醋中含有3%- 5%的乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是( )
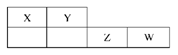 A.氢化物稳定性:X>Y
A.氢化物稳定性:X>Y
B.最高价氧化物对应的水化物的酸性:W>Y
C.4种元素的单质中,W单质的熔、沸点最高
D.干燥的W单质具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.分子中键能越大,键长越长,则分子越稳定
B.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道
C.PCl5分子中P原子和Cl原子最外层都满足8电子结构
D.用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com