
分析 钠的密度比水小,熔点低,将一小粒金属钠放入硫酸铜溶液中,Na先和H2O反应生成NaOH和H2,NaOH再和CuSO4发生复分解反应生成Cu(OH)2沉淀和Na2SO4;Na2O2和H2O反应生成NaOH和O2,无色酚酞试液遇碱变红色,但过氧化钠具有强氧化性,能漂白有色物质,据此分析解答.
解答 解:钠的密度比水小,熔点低,钠和水剧烈反应,将一小粒金属钠放入硫酸铜溶液中,Na先和H2O反应生成NaOH和H2,NaOH再和CuSO4发生复分解反应生成Cu(OH)2沉淀和Na2SO4,所以看到的现象是:钠块浮在水面上,熔成一只闪亮的小球,在水面上不定向地迅速游动,发出“嘶嘶”的响声,并产生蓝色沉淀,反应方程式为2Na+2H2O═2NaOH+H2↑;2NaOH+CuSO4═Cu(OH)2↓+Na2SO4;
Na2O2和H2O反应生成NaOH和O2,无色酚酞试液遇碱变红色,但过氧化钠具有强氧化性,能漂白有色物质,所以看到的现象是:溶液先呈红色,后褪色,涉及的化学反应方程式为2Na2O2+2H2O═4NaOH+O2↑,
故答案为:钠块浮在水面上,熔成一只闪亮的小球,在水面上不定向地迅速游动,发出“嘶嘶”的响声,并产生蓝色沉淀;2Na+2H2O═2NaOH+H2↑、2NaOH+CuSO4═Cu(OH)2↓+Na2SO4;红;褪色;过氧化钠的漂白性而使溶液褪色;2Na2O2+2H2O═4NaOH+O2↑.
点评 本题考查钠、过氧化钠的性质,为高频考点,侧重考查学生观察、分析判断及归纳能力,注意:过氧化钠具有漂白性,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3能与NaOH溶液反应,则Al(OH)3也能与氨水反应 | |
| B. | Al、Al2O3、Al(OH)3都可溶于NaOH溶液和盐酸中 | |
| C. | 向AlCl3溶液中滴加氨水,产生白色沉淀,再加过量NaHSO4溶液,沉淀消失 | |
| D. | 能用同一个离子方程式表示:氨水滴入Al2(SO4)3溶液和Al2(SO4)3溶液滴入浓氨水的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体 | |
| B. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
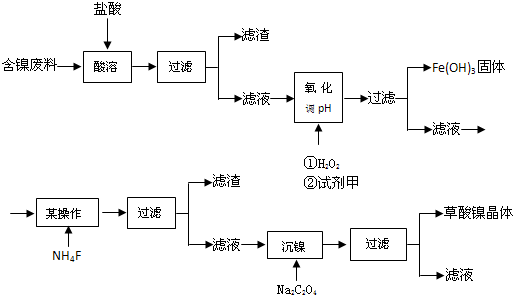
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+与S${\;}_{4}^{2-}$的物质的量浓度之比为2:3 | |
| B. | SO${\;}_{4}^{2-}$的物质的量为0.5mol | |
| C. | 1L溶液中含阴、阳离子共2.5NA个 | |
| D. | 从1L 0.5mol•L-1Al2(SO4)3溶液中取出100mL,Al3+浓度仍为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 235U比239 Pu原子核内少4个中子 | |
| B. | 核反应堆中使用的重水与水互为同位素 | |
| C. | 石油、天然气等化石燃料属于可再生能源 | |
| D. | 合理使用核能可有效减少温室气体的排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com