
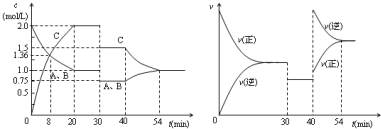
| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为放热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
分析 从该题图1可知,0-20min是反应:A(g)+xB(g)?2C(g)达到平衡的过程,20min时各浓度保持不变,正逆反应速率相等,反应达到平衡状态,20-30min,是保持平衡状态过程;反应物和生成物的浓度都减少,结合图象2知,正逆反应速率相等且减小平衡不移动;40-54min,图1知,反应物浓度增大生成物浓度减小,图2知正逆反应速率都增大,且与原平衡点无接触点,逆反应速率大于正反应速率,当正逆反应速率相等时,再次达到平衡状态.
解答 解:A、从图2可知,30min时正反应速率和逆反应速率同时降低.降低反应温度,正反应速率和逆反应速率同时降低,但降低反应温度,平衡向放热反应方向移动.该反应无论正反应方向放热还是吸热,平衡均移动与图2中30-40min,改变条件后,平衡不移动矛盾,故A错误.
B、0~8min内,C的反应速率v=$\frac{1.36mol/L}{8min}$=0.17mol/(L•min)-1,化学反应速率之比等于方程式的系数之比,所以A的平均反应速率为0.085mol/(L•min)-1,故B错误;
C.由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故C正确;
D、由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,所以平衡常数不变,故D正确.
故选:CD.
点评 本题考查化学平衡图象问题,题目难度较大,本题注意根据图象浓度的变化以及反应速率的变化判断化学反应状态以及影响化学反应速率的条件,本题易错,答题时注意思考.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
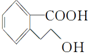 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | 该分子中存在一个手性碳原子 | |
| B. | M的分子式为C9H10O3 | |
| C. | 1 mol M能与足量Na反应生成0.5 mol H2 | |
| D. | 1 mol M完全燃烧消耗10 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
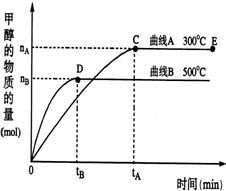 一定条件下,在体积为2L的密闭容器中,一氧化碳与氢气在催化剂作用反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).根据题意完成下列各题:
一定条件下,在体积为2L的密闭容器中,一氧化碳与氢气在催化剂作用反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).根据题意完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分大部分蒸干后,停止加热,利用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 浓硫酸稀释时,应该将水缓缓加入盛浓硫酸的烧杯中,边加边搅拌 | |
| D. | 萃取分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | 石墨转变为金刚石是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +
+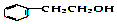 →
→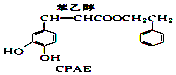 +H2O.
+H2O.| A. | 1molCPAE和1mol咖啡酸分别与足量的NaOH溶液反应,均最多消耗3molNaOH | |
| B. | 与苯乙醇互为同分异构体的酚类物质共有9种 | |
| C. | FeCl3溶液可区别咖啡酸和CPAE | |
| D. | 咖啡酸可发生聚合反应,并且其分子中含有3种官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com