
| A. | 原子半径的大小顺序r(X)>r(Y)>r(Z)>r(R)>r(W) | |
| B. | 氢气在R的单质中燃烧火焰呈蓝色 | |
| C. | 元素X的氢化物的稳定性比Y的弱 | |
| D. | Y与Z形成的两种化合物中的化学键类型均相同 |
分析 X、Y、Z、W、R是短周期主族元素,X原子最外层电子数是次外层的两倍,原子只能有2个电子层,最外层电子数为4,则X为C元素;Y元素在地壳中的含量最多,则Y为O元素;Z元素的化合物的焰色反应呈黄色,则Z为Na;W 元素的最高价氧化物的水化物不溶于水,可溶于Z元素的最高价氧化物的水化物,则W为Al;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R的原子序数为17,故R为Cl,据此解答.
解答 解:X、Y、Z、W、R是短周期主族元素,X原子最外层电子数是次外层的两倍,原子只能有2个电子层,最外层电子数为4,则X为C元素;Y元素在地壳中的含量最多,则Y为O元素;Z元素的化合物的焰色反应呈黄色,则Z为Na;W 元素的最高价氧化物的水化物不溶于水,可溶于Z元素的最高价氧化物的水化物,则W为Al;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R的原子序数为17,故R为Cl.
A.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径:Z(Na)>W(Al)>R(Cl)>X(C)>Y(O),故A错误;
B.氢气在氯气中燃烧火焰呈苍白色,故B错误;
C.非金属性X(C)<Y(O),故元素X的氢化物的稳定性比Y的弱,故C正确;
D.Y与Z形成的两种化合物为氧化钠、过氧化钠,前者只含有离子键,后者含有离子键、共价键,故D错误,
故选:C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 mol Na2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17 g NH3所含电子数之比为9:10 | |
| D. | 1mol Na2CO3晶体中含 CO${\;}_{3}^{2-}$离子数小于1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO${\;}_{4}^{2-}$ | |
| B. | Fe(OH)3的电离:Fe(OH)3?Fe3++3OH- | |
| C. | H2CO3的电离:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 水溶液中的NaHSO4电离:NaHSO4═Na++HSO${\;}_{4}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
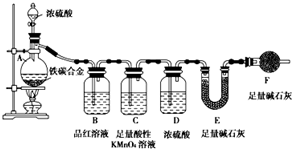 现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
| 指示剂 | 变色范围(pH) | 颜色 | |
| 酸 | 碱 | ||
| 甲基橙 | 3.1~4.4 | 红 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电泳现象可证明胶体带电荷 | |
| B. | 胶体是一种纯净物 | |
| C. | 胶体属于介稳体系 | |
| D. | 将饱和氯化铁溶液滴入氢氧化钠溶液中制备氢氧化铁胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com