
【题目】下列说法正确的是
A. 酿酒过程中,葡萄糖可通过水解反应生成酒精
B. 鸡蛋清溶液中加入饱和硫酸钠溶液,生成的沉淀物不能再溶解
C. 油脂均不能使酸性高锰酸钾褪色
D. 脂肪能发生皂化反应,生成甘油和高级脂肪酸盐
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡,下列说法正确的是
CH3OH(g)达到平衡,下列说法正确的是
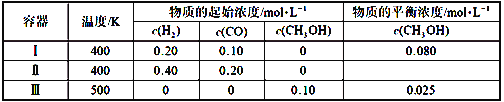
A. 该反应的正反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
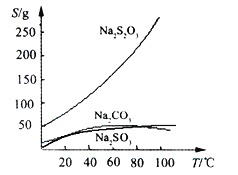
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3 + S ![]() Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下图所示。

Ⅰ.现按如下方法制备Na2S2O35H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
(1)仪器2的名称为_________________,装置6中可放入_____________________(填字母)。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2 =Na2SO3+CO2 ②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O ④Na2SO3+S![]() Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出,继续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7理由是____________________________________(用离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并标定溶液的浓度:

(3)为减少产品的损失,操作①为__________,操作②是抽滤洗涤干燥,其中洗涤操作是用_______(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高______________________________。
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-, 三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代酸钠溶液的浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸与二氧化锰固体加热反应来制备氯气(MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O),某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题:
MnCl2+Cl2↑+2H2O),某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题: 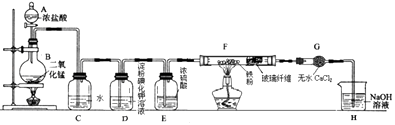
(1)仪器A的名称是 .
(2)C中反应的化学方程式为 , 所得溶液除水分子外,还含有的分子和离子中正确的是 .
A.Cl2、HCl、HClO,H+、Cl﹣ B.Cl2、Mn2+、HClO,H+、Cl﹣
C.Cl2、HClO,H+、Cl﹣、ClO﹣ D.Cl2、HCl、HClO,H+、Mn2+
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,碘单质(I2)遇淀粉显蓝色,且氯气可以从KI中置换出碘单质,写出该反应的化学方程式为 .
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解,100℃左右时升华.E中浓硫酸的作用是 , 双通管F中玻璃纤维(不参与反应)的作用是 .
(5)H中盛有NaOH溶液,其作用是 , 发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C6H12O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C,则有机物A的可能结构有( )
A. 1种B. 2种C. 3种D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与盐类水解无关的是
A.金属焊接时可用NH4Cl溶液作除锈剂 B.配制FeSO4溶液时,加入一定量Fe粉
C.长期施用铵态氮肥会使土壤酸化D.使用泡沫灭火器灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是________(填字母)。
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH > 0
B.2H2(g)+O2(g)===2H2O(l) ΔH < 0
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH < 0
(2)固体氧化物燃料电池的工作原理如图所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动。
①正极:________ (填“电极a”或“电极b”)。 O2-移向________极(填“正”或“负”)。

②当燃料气为C2H4时,其正极、负极反应式分别为
正极:______________________;负极:____________________。
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,则除去甲醇的离子方程式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com