

 .
.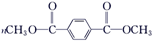 +
+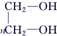 $\stackrel{H+}{?}$
$\stackrel{H+}{?}$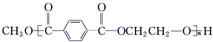 +(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种.
+(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种. 合成
合成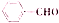 的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:
的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:分析 根据C在酸性条件下水解生成 和CH3COOH可知,该反应为酯的水解,C的结构简式为:
和CH3COOH可知,该反应为酯的水解,C的结构简式为: ;B通过反应生成C,该反应应该为加聚反应,则B为
;B通过反应生成C,该反应应该为加聚反应,则B为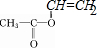 ;CH3COOH与M发生加成反应生成B,则M为CH≡CH;
;CH3COOH与M发生加成反应生成B,则M为CH≡CH;
有机物A组成中含碳37.5%,含氢12.5%,其余是氧,则A分子中C、H、O原子个数之比为:$\frac{37.5%}{12}$:$\frac{12.5%}{1}$:$\frac{1-37.5%-12.5%}{16}$=1:4:1,则A的最简式为CH4O,由于H原子已经达到饱和,则A为甲醇(CH3OH);结合A与HBr反应得D,D与甲苯反应生成E,E氧化生成F,F与甲醇反应生成G可知,F为 、E为
、E为 、D为CH3Cl;G→聚酯纤维的反应为水解反应,反应的化学方程式为:
、D为CH3Cl;G→聚酯纤维的反应为水解反应,反应的化学方程式为: +
+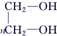 $\stackrel{H+}{?}$
$\stackrel{H+}{?}$ +(2n-1)CH3OH,据此进行解答.
+(2n-1)CH3OH,据此进行解答.
解答 解:根据C在酸性条件下水解生成 和CH3COOH可知,该反应为酯的水解,C的结构简式为:
和CH3COOH可知,该反应为酯的水解,C的结构简式为: ;B通过反应生成C,该反应应该为加聚反应,则B为
;B通过反应生成C,该反应应该为加聚反应,则B为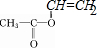 ;CH3COOH与M发生加成反应生成B,则M为CH≡CH;
;CH3COOH与M发生加成反应生成B,则M为CH≡CH;
有机物A组成中含碳37.5%,含氢12.5%,其余是氧,则A分子中C、H、O原子个数之比为:$\frac{37.5%}{12}$:$\frac{12.5%}{1}$:$\frac{1-37.5%-12.5%}{16}$=1:4:1,则A的最简式为CH4O,由于H原子已经达到饱和,则A为甲醇(CH3OH);结合A与HBr反应得D,D与甲苯反应生成E,E氧化生成F,F与甲醇反应生成G可知,F为 、E为
、E为 、D为CH3Cl,
、D为CH3Cl,
(1)根据分析可知,A为CH3OH,其分子式为:CH4O;B为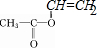 ,其含有的官能团为碳碳双键和酯基;C的结构简式为:
,其含有的官能团为碳碳双键和酯基;C的结构简式为: ,
,
故答案为:CH4O;  ;酯基、碳碳双键;
;酯基、碳碳双键; ;
;
(2)D→E的反应CH3Cl与甲苯反应生成 和HCl,该反应为取代反应;F为
和HCl,该反应为取代反应;F为 ,其名称为对苯二甲酸(或1,4苯二甲酸),
,其名称为对苯二甲酸(或1,4苯二甲酸),
故答案为:取代反应; 对苯二甲酸(或1,4苯二甲酸);
(3)G→聚酯纤维的反应为缩聚反应,该反应的化学方程式为: +
+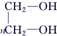 $\stackrel{H+}{?}$
$\stackrel{H+}{?}$ +(2n-1)CH3OH;
+(2n-1)CH3OH;
G为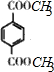 ,②1mol该物质与足量的NaHCO3溶液反应生成2molCO2气体,说明有机物分子中含有2个羧基又①苯环上只有两个取代基,则其取代基可能为:①-COOH、-CH2CH2COOH、②-CH2COOH、-CH2COOH、③-COOH、-CH(CH3)COOH、④-CH3、CH(COOH)2,每一种存在邻、间、对三种结构,所有总共有含有3×4=12种结构,
,②1mol该物质与足量的NaHCO3溶液反应生成2molCO2气体,说明有机物分子中含有2个羧基又①苯环上只有两个取代基,则其取代基可能为:①-COOH、-CH2CH2COOH、②-CH2COOH、-CH2COOH、③-COOH、-CH(CH3)COOH、④-CH3、CH(COOH)2,每一种存在邻、间、对三种结构,所有总共有含有3×4=12种结构,
故答案为: +
+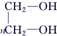 $\stackrel{H+}{?}$
$\stackrel{H+}{?}$ +(2n-1)CH3OH;12;
+(2n-1)CH3OH;12;
(4)由 合成
合成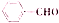 ,根据逆合成法,
,根据逆合成法,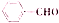 可以由
可以由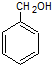 催化氧化生成,苯甲醇可以由
催化氧化生成,苯甲醇可以由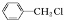 通过水解反应生成,
通过水解反应生成,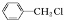 可用甲苯与氯气通过取代反应生成,所以合成流程为
可用甲苯与氯气通过取代反应生成,所以合成流程为 ,
,
故答案为: .
.
点评 本题考查了有机合成,题目难度较大,明确合成原理及常见有机物结构与性质为解答关键,试题侧重考查学生的分析、理解能力,(3)中同分异构体的书写为解答难点、易错点,需要根据题中性质条件明确满足条件的有机物分子中两个取代基结构.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 配体为水分子,配原子为O,外界为Br- | |
| B. | 中心离子的配位数为6 | |
| C. | 中心离子Cr3+采取sp3杂化 | |
| D. | 中心离子的化合价为+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
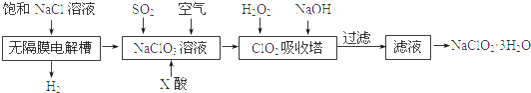
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
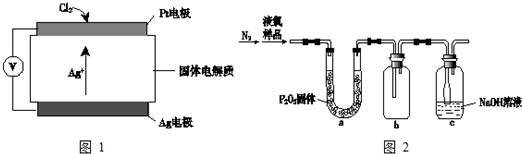
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
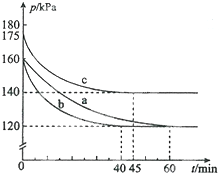 化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
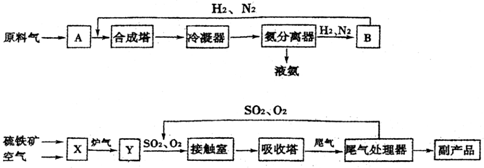
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
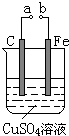
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,碳棒上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b分别连接直流电源正、负极,在电路中通过0.5mol电子后反接,又通过1mol电子,此时溶液中的c(H+)是2mol•L-1(假定溶液体积不变) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com