
 (1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,换句话说:化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关
(1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,换句话说:化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关分析 (1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,据此分析;
(2)化学平衡两个本质特征是反应物各组分的浓度保持不变和正反应速率等于逆反应速率不等于零;
(3)①2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,
②2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.
根据盖斯定律可知:将$\frac{①-②}{2}$计算;
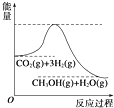
(4)根据该反应的能量变化图,反应物总能量大于生成物总能量,所以则该反应为放热反应;平衡常数K的表达式K=$\frac{c(CH{\;}_{3}OH)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2}){\;}^{3}}$,根据反应为放热反应,则温度降低,平衡向正反应方向移动,则平衡常数K增大.
解答 解:(1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,即化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关,故答案为:相同;始态;终态;途径;
(2)化学平衡两个本质特征是反应物各组分的浓度保持不变和正反应速率等于逆反应速率不等于零,
故答案为:各组分的浓度保持不变;正反应速率等于逆反应速率不等于零;
(3)已知:①2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,
②2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.
根据盖斯定律可知:将$\frac{①-②}{2}$可得:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=$\frac{-196.6+113}{2}$=-41.8 kJ•mol-1
故答案为:-41.8;
(4)根据该反应的能量变化图,反应物总能量大于生成物总能量,所以则该反应为放热反应,则逆反应为吸热反应;平衡常数K的表达式K=$\frac{c(CH{\;}_{3}OH)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2}){\;}^{3}}$,因为反应为放热反应,则温度降低,平衡向正反应方向移动,则平衡常数K增大,故答案为:吸热; K=$\frac{c(CH{\;}_{3}OH)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2}){\;}^{3}}$;增大.
点评 本题考查了盖斯定律的定义及其应用、化学反应与能量图的关系以及平衡常数的判断等,难度不大,属于基础型题目.


科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中的反应物,不是氧化剂就是还原剂 | |
| B. | 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 金属氧化物一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小H2O2溶液的浓度 | B. | 降低温度 | ||
| C. | 加入少量MnO2粉末 | D. | 向溶液中加入蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L | |
| B. | 将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol/L | |
| C. | 0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数约为3×6.02×1023 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的物质的量浓度是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发废旧电池综合利用技术,防止其中重金属盐对土壤水资源造成污染 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于铝在常温下不能与氧气反应,所以铝制品具有一定的抗腐蚀性能,是一种应用广泛的金属材料 | |
| B. | 青铜、不锈钢、硬铝都是合金 | |
| C. | 铜表面易形成致密保护膜 | |
| D. | 装修门窗使用的铝合金材料的硬度比铝小,熔点比铝低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏装置图:
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏装置图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com