
| A、钢铁发生吸氧腐蚀时的正极反应:O2+4e-+4H+═2H2O |
| B、小苏打水解反应的离子方程式:HCO3-+H2O?CO32-+H3O+ |
| C、氯碱工业和工业冶炼金属钠的阳极反应均为:2Cl--2e-═Cl2↑ |
| D、NaAlO2溶液中通入足量CO2的离子方程式:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
| A、每有1mol NO3-反应,生成22.4L N2(标准状况) |
| B、每有1mol Al反应,被氧化的NO3-物质的量为0.6mol |
| C、配平该反应方程式,Al的化学计量系数是10 |
| D、该反应使用的盐可以是Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
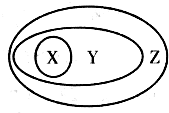
| X | Y | Z | |
| A | 硫酸 | 含氧酸 | 酸 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 化合物 | 纯净物 |
| D | 酸性氧化物 | 非金属氧化物 | 氧化物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
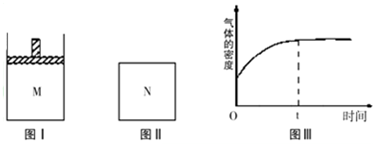
| A、x=2 |
| B、若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态 |
| C、A为气体,B为非气体,则平衡时M、N中C的物质的量相等 |
| D、若A、B均为气体,平衡时M中A的转化率小于N中A的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L水中含有的水分子数是NA |
| B、0.10mol?L-1NaCl溶液中含有Cl-离子数是0.1NA |
| C、NA个O2分子的质量是16g |
| D、N=n?NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
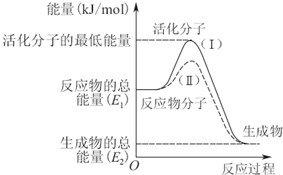 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图,然后回答问题.| 1 |
| 2 |
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能(kJ?mol-1) | 386 | 167 | 498 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,虚线框中每一列、每一行分别对应元素周期表中的一列和一行,但它的列数和行数都多于元素周期表.
如图所示,虚线框中每一列、每一行分别对应元素周期表中的一列和一行,但它的列数和行数都多于元素周期表.查看答案和解析>>
科目:高中化学 来源: 题型:
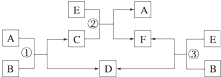 已知A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.试回答下列问题:
已知A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com