
在常温常压下,将aLSO2和bLH2S混合,当反应后恢复到原状态时,气体体积是反应前气体体积的四分之一时,则a与b之比为
A.1:1 B.1:2 C.1:3 D.1:4
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| c(CH3OH) |
| c(CO)?c2H(2) |
| c(CH3OH) |
| c(CO)?c2H(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Y | V | |||
| X | W |
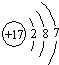
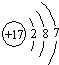
| ||
| ||



查看答案和解析>>
科目:高中化学 来源:2010年西藏拉萨中学高一第二学期期末考试化学试题 题型:填空题
(10分)今有下列两组单质,试将每组单质从不同角度进行“分类”,每种“分类”都可分别挑出一种单质,它跟其他三种单质属于不同的“类”,将挑出的单质(写化学符号)和挑选依据(写编码)列在下面相应的表格内:
两组单质为:Ⅰ.O2、F2、S、N2 Ⅱ.Fe、Na、Al、Si
“挑选依据”仅限于下述六种。该被挑出的单质跟其他三种单质不同,是由于:(A)其组成元素不属于金属(或非金属);(B)其组成元素不属于周期表中的同一族;(C)其组成元素不属于周期表中的同一周期;(D)其组成元素不属于主族(或副族)元素;(E)在常温常压下呈不同物态;(F)在常温下遇水能(或不能)迅速产生气体。
|
|
答案1 |
答案2 |
答案3 |
答案4 |
答案5 |
答案6 |
|
单质 |
Si |
|
|
|
|
|
|
挑选依据 |
A |
|
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 在常温常压下,将0.5mol 硫放中足量氧气中充分反应生成SO2(g),放热148kJ,其热化学方程式为:
S(s)+O2(g)==SO2 (g) △H=+296kJ·mol-1
C. 氧化铝溶于NaOH溶液: Al2O3+OH- +H2O == Al(OH)3
D.氯化镁溶液与氢氧化钾溶液反应:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com