
| A. | 5.6 L | B. | 22.4 L | C. | 4.48 L | D. | 无法计算 |
分析 先计算出混合溶液中氢离子、硝酸根离子的物质的量,然后根据反应方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O判断过量情况,根据不足量计算出生成NO的物质的量,再计算出标况下一氧化氮的体积.
解答 解:该HNO3和H2SO4混合酸溶液中含义氢离子的物质的量为:n(H+)=1moL+2×4moL=9mol,n(NO3-)=1mol,
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3 8 2 2
1.5mol铜完全反应消耗氢离子的物质的量为:1.5mol×$\frac{8}{3}$=4mol,
1mol硝酸根离子完全反应消耗4mol氢离子,消耗1.5molCu,
显然氢离子过量,铜与硝酸根离子恰好反应,
则反应生成NO的物质的量为:1.5mol×$\frac{2}{3}$=mol,
标况下生成的NO的体积为:22.4L/mol×1mol=22.4L,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,根据反应方程式及题中数据正确判断反应物过量情况为解答关键,注意熟练掌握常见化学反应原理,试题培养了学生的化学计算能力.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝酸、纯碱、明矾和氧化铁分别属于酸、碱、盐和氧化物 | |
| B. | 氯化氢、氯气、二氧化氮溶于水都能导电,都是电解质 | |
| C. | 煤的气化、液化都是化学变化,可为人类提供清洁高效的燃料 | |
| D. | 氨水、醋、84消毒液中都存在电离平衡,它们都是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
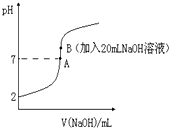 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF?H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF?H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离产生的c(H+)=10-12 mol•L一1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | pH=13的溶液中:K+、Ba2+、Cl-、OH- | |
| D. | pH=13的溶液中:NH4+、Na+、HS-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡左移,容器内压强不一定增大 | |
| B. | 平衡右移,达到平衡时容器内压强一定增大 | |
| C. | 平衡右移,SO2的转化率提高 | |
| D. | 平衡不一定移动,容器内压强一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室常用以下方法制取氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
实验室常用以下方法制取氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Fe和Fe2O3的混合物投入250mL 2mol/L硝酸溶液中,反应完全后,生成2.24L NO(标况),再向反应后的溶液中加入1mol/LNaOH溶液,要使铁元素完全沉淀下来,所加入的NaOH溶液体积最少是( )
Fe和Fe2O3的混合物投入250mL 2mol/L硝酸溶液中,反应完全后,生成2.24L NO(标况),再向反应后的溶液中加入1mol/LNaOH溶液,要使铁元素完全沉淀下来,所加入的NaOH溶液体积最少是( )| A. | 450mL | B. | 500mL | C. | 400mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com