
| A. | 铁锈与稀硫酸 | |
| B. | FeCl3和CuCl2的混合溶液与过量铁粉 | |
| C. | 过量Fe0与稀硝酸 | |
| D. | FeS04酸性溶液与KN03溶液 |
分析 物质反应后,再滴入KSCN溶液不显红色,说明溶液中不含Fe3+,根据反应后溶液中阳离子成分分析解答.
解答 解:物质反应后,再滴入KSCN溶液不显红色,说明溶液中不含Fe3+,
A.铁锈的成分是Fe2O3.xH2O,铁锈和稀硫酸反应方程式为Fe2O3.xH2O+3H2SO4=Fe2(SO4)3+(3+x)H2O,含有Fe3+,所以滴入KSCN溶液后溶液呈血红色,故A不选;
B.FeCl3和CuCl2的混合溶液与过量铁粉发生反应为2FeCl3+Fe=3FeCl2、CuCl2+Fe=FeCl2+Cu,溶液中没有Fe3+,所以滴入KSCN溶液后溶液不呈红色,故B选;
C.发生的反应为3FeO+4HNO3=3Fe(NO3)3+NO↑+2H2O,溶液中有Fe3+,所以滴入KSCN溶液后溶液呈血红色,故C不选;
D.发生的反应为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,溶液中有Fe3+,所以滴入KSCN溶液后溶液呈血红色,故D不选;
故选B.
点评 本题以铁离子检验为载体考查氧化还原反应,明确溶液中溶质成分是解本题关键,知道铁离子、亚铁离子检验方法及现象,易错选项是D,注意:酸性条件下亚铁离子能被硝酸根离子氧化,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 使电流通过电解质溶液而在阴、阳两极引起氧化还原反应,此过程中电能转化为化学能 | |
| B. | 一定条件下进行的化学反应,只能将化学能转化成光能或热能 | |
| C. | 需要加热才能进行的反应一定是吸热反应,放热反应不需要加热 | |
| D. | 将NaHCO3溶液蒸干后并加热至质量不发生变化,最终所得固体仍为NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
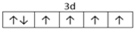 ,
,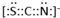 .F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为12×6.02×1023个或12NA
.F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为12×6.02×1023个或12NA查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| B. | 含有金属阳离子的晶体不一定是离子晶体 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸、氯水保存在棕色试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的金属钠存放于煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
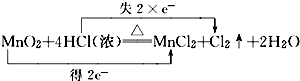 ,若反应中生成11.2L的Cl2(标准状况),问转移电子的物质的量是1mol
,若反应中生成11.2L的Cl2(标准状况),问转移电子的物质的量是1mol
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
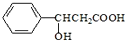 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 既能跟NaOH溶液反应,又能与金属钠反应 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 分子式为:C9H11O3 | |
| D. | 不能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com