
| 选项 | 电极反应式 | 出现的环境 |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | Cu-2e-═Cu2+ | 用铜做电极电解NaOH溶液的阳极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4溶液的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碱性条件下的氢氧燃料电池中,氢气在负极上失电子发生氧化反应,氧气在正极上得电子发生还原反应;
B.弱酸性环境下,钢铁发生吸氧腐蚀,正极上氧气得电子发生还原反应;
C.用铜作电极电解氢氧化钠溶液,阳极铜是活性电极,优先溶液中的阴离子失电子发生氧化反应,阴极上阳离子氢离子优先得电子发生还原反应;
D.用惰性电极电解H2SO4溶液时,阳极上氢氧根离子优先失电子发生氧化反应.
解答 解:A.碱性条件下的氢氧燃料电池中,氢气在负极上的电极反应式为:H2-2e-+2OH-=2H2O,故A错误;
B.弱酸性环境下钢铁的吸氧腐蚀,正极上氧气得电子生成氢氧根离子,电极反应式为:O2↑+2H2O+4e-=4OH-,故B错误;
C.用铜做电极电解NaOH溶液时,阳极铜是活性电极,放电能力强于溶液中的氢氧根,电极反应式为:Cu-2e-═Cu2+,故C正确;
D.用惰性电极电解H2SO4溶液时,阳极上氢氧根离子放电能力强于硫酸根离子,电极反应式为:4OH--4e-=O2↑+2H2O,故D错误;
故选C.
点评 本题考查原电池和电解池原理,明确阴阳极和正负极上的反应类型是解本题的关键,注意电解池中离子的放电顺序,铜作电解池阳极时,阳极上铜失电子而不是溶液中阴离子失电子,为易错点.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
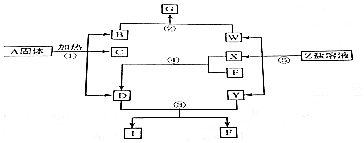
| A. | 化学能转化成机械能在转化成电能 | |
| B. | 化学能转化成热能在转化成电能 | |
| C. | 化学能转化成机械能在转化成热能在到机械能 | |
| D. | 化学能转化成热能在转化成机械能在到电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
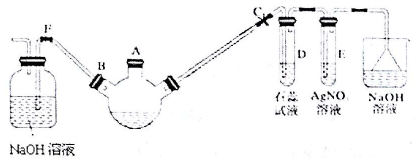
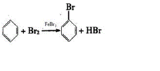 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期的实验现象和结论 |
| 步骤:取一定量的固体产物于试管中,加入适量蒸馏水进行溶解,然后往试管中加入适量的 CuCl2溶液并过滤. | \ |
| 步骤2: 取1的滤液加入酚酞试液,若溶液变红, | 说明有NaOH |
| 步骤3: 取1的滤液加入BaCl2溶液,若产生白色沉淀, | 说明有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制氯乙烷:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | 制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH $\stackrel{Pd}{→}$ CH2=C(CH3)COOCH3 | |
| C. | 制CuSO4:2Cu+O2=2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
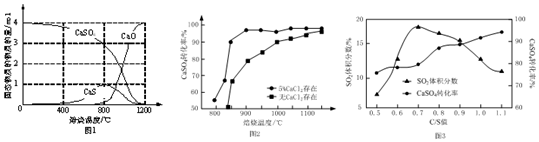
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com