
【题目】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为l∶2,下列有关说法正确的是( )
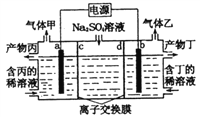
A. a电极反应式为:2H++2e-= H2↑
B. 产物丙为硫酸溶液
C. 离子交换膜d 为阴离子交换膜
D. 每转移0.1mol电子,产生1.12 L的气体乙
【答案】B
【解析】电解硫酸钠溶液时,阳极上生成氧气,电极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为 4H2O+4e-=2H2↑+4OH-,测得同温同压下,气体甲与气体乙的体积比约为1:2,则甲是氧气、乙是氢气,则a是阳极、b是阴极,阳极区域生成硫酸、阴极区域生成NaOH。A.a为阳极,电极反应式为2H2O-4e-=O2↑+4H+,故A错误;B.通过以上分析知,a为阳极,同时生成硫酸,所以产物丙是硫酸,故B正确;C.产物丁是NaOH,则离子交换膜d是阳离子交换膜,故C错误;D.生成乙的电极反应式为4H2O+4e-=2H2↑+4OH-,每转移0.1 mol电子,产生氢气的物质的量为0.05mol,但温度和压强未知,故无法确定气体摩尔体积,则无法计算氢气的体积,故D错误;答案选B


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:2A(g)+B(s)C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( ) ①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A,C,D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molC,同时生成n mol D
⑥单位时间内生成n molD,同时生成2n mol A.
A.①②⑤
B.②③④
C.②③⑥
D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同一周期也不在同一主族,D的氢化物及其最高价氧化物对应的水化物均为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D的氢化物中,沸点较低的是 (选“A”或“D”)。
(2)元素C在元素周期表中的位置是 ,B的最高价氧化物对应的水化物的电子式为 。
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为 。它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )
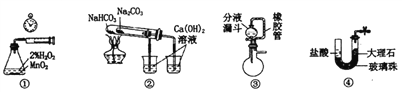
A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOHCH3COO﹣+H+ , 要使溶液中 ![]() 比值增大,可以采用的措施是( )
比值增大,可以采用的措施是( )
A.加少量CH3COONH4固体
B.加浓醋酸
C.加少量NaCl固体
D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A.Mg2+、H+、Cl-、HCO3-B.K+、NH4+、NO3-、CO32-
C.NH4+、Na+、SO42-、OH-D.Ag+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ/mol
CH2=CH2(g)+4H2O(g) △H=akJ/mol
请回答:
(1)已知:H2和CH2=CH的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)![]() H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
(2)上述由CO2合成CH2=CH2的反应在________下自发进行(填“高温”或“低温”)。
(3)在体积为1L的恒容密闭容器中,充入3molH2和1molCO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是________。

A.平衡常数大小:KMN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n(H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,t0时达到化学平衡。请在图2中作出容器内混合气体的平均相对分子质量![]() 随时间变化的图象。___________
随时间变化的图象。___________

Ⅱ.利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:

(5)放电时,正极的电极反应式为__________________。
(6)若生成的Na2CO3和C全部沉积在正极表面,当转移0.2mole-时,正极增加的质量为_______g。
(7)选用高氯酸钠四甘醇二甲醚做电解液的优点是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3.试回答下列问题:
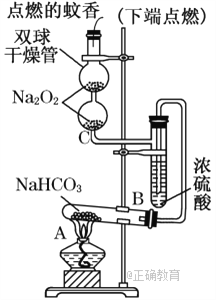
(1)在A试管内发生反应的化学方程式是____________________________________.
(2)B装置的作用是_______________________________________________________.
(3)在双球干燥管内发生反应的化学方程式为___________________________________.
(4)双球干燥管内观察到的实验现象是_________________________________________.上述实验现象说明________________________________________________________.
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是______________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下pH=12的NaOH溶液中,由水电离出的c(OH﹣)是( )
A.1×10﹣2mol/L
B.1×10﹣7mol/L
C.1×10﹣12mol/L
D.1×10﹣14mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com