
分析 (1)由元素周期表结构,对于处于ⅠA、ⅡA元素而言,不同周期相邻主族的元素的原子序数差值不同,对于处于其他主族元素而言,不同周期相邻主族的元素的原子序数差值也不同,由此分析解答;
(2)同周期的ⅡA族元素、ⅦA族元素若在短周期元素,中间有5个纵行;在四、五周期,中间有15个纵行;在五、六周期应注意存在镧系和锕系,中间是14+15=29个纵行,以此来解答.
解答 解:(1)由元素周期表结构可知,对于处于同一主族不同周期的元素,原子序数相差可能为2、8、18、32,甲的原子序数为x,所以乙的原子序数可能是x+2、x+8、x+18、x+32,故答案为:x+2、x+8、x+18、x+32;
(2)同周期的ⅡA族元素、ⅦA族元素若在短周期元素,中间有5个纵行;在四、五周期,中间有15个纵行;在五、六周期应注意存在镧系和锕系,中间是14+15=29个纵行,甲、乙的原子序数分别是m和n,所以m和n的关系为:n=m+5、n=m+15、n=m+29,故答案为:n=m+5、n=m+15、n=m+29.
点评 本题考查学生元素周期表的结构知识,可以根据所学内容来回答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 核外电子是分层排布的 | |
| B. | 在化学变化中,活泼金属元素容易失去电子形成阳离子,活泼非金属元素溶液得到电子形成阴离子 | |
| C. | 活泼金属或非金属元素通过电子得失形成离子时,最外层电子趋向于形成类似稀有气体原子的稳定结构 | |
| D. | 原子核外电子绕核做圆周运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 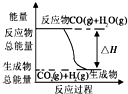 如图表示反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H>0 | |
| B. | 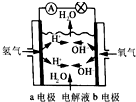 如图为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1 | |
| C. | 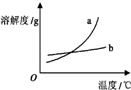 如图表示物质a、b的溶解度曲线,可以用重结晶方法从a、b混合物中提纯a | |
| D. |  如图可以表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,且乙的压强小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相同的原子,其核外电子排布也相同 | |
| B. | 质量数相同的不同原子,其化学性质一定相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该灰黑色粉末用作抗氧化剂 | B. | 小袋中的原装粉末是Fe2O3 | ||
| C. | 小袋中可能装有活性铁粉 | D. | 该灰黑色粉末不可食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| B. | 强电解质都是可溶性化合物,弱电解质都是难溶化合物 | |
| C. | 强电解质的水溶液导电能力强,弱电解质导电能力弱 | |
| D. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石晶胞(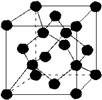 )中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8 )中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8 | |
| B. | 二氧化硅晶体中最小环上的氧原子数、氯化铯晶体中氯离子的配位数均为6 | |
| C. | 锌晶胞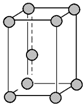 中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12 中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12 | |
| D. | 33g CH≡C-CH=CH-CH3中所含的π键数、12g石墨中所含的碳碳键数均为1.5mol. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com