




 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:实验题
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2 SO3的叙述错误的是
2 SO3的叙述错误的是| A.增加O2的浓度能加快反应速率 |
| B.若O2足量,则SO2可以完全转化为SO3 |
| C.加入催化剂能加快反应速率 |
| D.升高体系温度能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②④ | C.①②③④ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
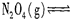


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Al | 0.2 mol | 18.4mol/L H2SO4 | 10mL | 30℃ |
| B | Mg | 0.2 mol | 3 mol/L H2SO4 | 20mL | 30℃ |
| C | Fe | 0.1 mol | 3 mol/L H2SO4 | 20mL | 60℃ |
| D | Mg | 0.1 mol | 3 mol/L H2SO4 | 10mL | 60℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸钠(固体) | B.硝酸钾溶液 | C.硫酸钾溶液 | D.硫酸铵(固体) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO(g),能使反应速率加快的措施是( )
2CO(g),能使反应速率加快的措施是( )| A.①②③⑥ | B.①②④⑥ |
| C.①②③④ | D.①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com