
【题目】下列各组离子一定能大量共存的是( )
A.在无色溶液中:NH4+、Fe2+、SO42﹣、CO32﹣
B.在含大量Ba2+的溶液中:NH4+、Na+、Cl﹣、OH﹣
C.在强碱溶液中:Na+、K+、Cl﹣、SO32﹣
D.在pH=1的溶液中:K+、Fe2+、Cl﹣、CH3COO﹣
科目:高中化学 来源: 题型:
【题目】有A、B两个完全相同的装置,某学生分别在它们的侧管中装入一定量的Na2CO3和NaHCO3,A、B中分别装有足量的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
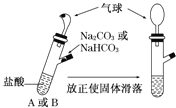
A. 侧管中装入Na2CO3的气球膨胀速率大
B. 若加入等质量的Na2CO3和NaHCO3 ,最终两气球体积不同
C. 最终两试管中Na+、Cl-的物质的量一定相同
D. 热稳定性:Na2CO3 < NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图a、b、c、d均为铂电极,供选择的电解质溶液如下表( )
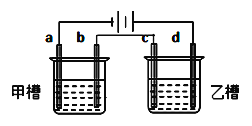
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
组 | A | B | C | D |
甲槽 | NaOH | Cu(NO3)2 | KCl | Na2SO4 |
乙槽 | CuSO4 | NaCl | AgNO3 | NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)![]() CH3OH(g)H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
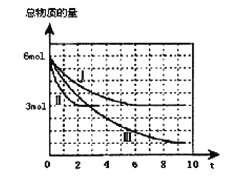
(1)能判断反应达到化学平衡状态的是 (填字母)。
A.c(CO)与c(H2)的比值保持不变
B.容器中气体压强保持不变
C.容器中气体密度保持不变
D.单位时间内有1molCO消耗的同时有1mol CH3OH生成
E.v正(H2)=2 v逆(CH3OH)
(2)①Ⅱ和Ⅰ相比,Ⅱ改变的反应条件是 。
②反应Ⅲ在9min时达到平衡,比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),此正反应是________反应(填“放热或吸热”)。
(3)①反应Ⅰ在6 min时达到平衡,从反应开始到达到平衡时v (CH3OH) = mol/(L·min)。
②反应Ⅱ在2 min时达到平衡,计算该温度下的平衡常数K= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后,平衡将向_________(填“正反应、逆反应和不移动”),原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验:
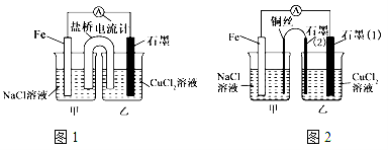
(1)如上图1为某实验小组依据氧化还原反应设计的原电池装置,若盐桥中装有饱和的KNO3溶液和琼胶制成的胶冻,则NO3-移向_____________装置(填写“甲或乙”)。其他条件不变,若将CuCl2溶液换为NH4Cl溶液,发现生成无色无味的单质气体,则石墨上电极反应式______________________。
(2)如上图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则甲装置是____________(填“原电池或电解池”),乙装置中石墨(2)为 极,乙装置中与铁线相连的石墨(1)电极上发生的反应式为 。
(3)在图2乙装置中改为加入CuSO4溶液,一段时间后,若某一电极质量增重 1.28 g,则另一电极生成______________mL(标况下)气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某非金属单质A和氧气发生化合反应生成B,B为气体,其体积是反应掉氧气体积的两倍(同温同压)。关于B分子组成的推测一定正确的是( )
A.有1个氧原子 B.有2个氧原子 C.有1个A原子 D.有2个A原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2 = P4O10。已知断裂下列化学键需要吸收的能量分别为:E(P—P) = a kJ·mol-1、E(P—O) = b kJ·mol-1、E(P=O) = c kJ·mol-1、E(O=O) = d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
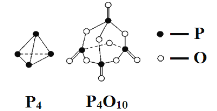
A.-(6a-12b-4c+5d)kJ·mol-1
B.-(-6a+12b+4c-5d)kJ·mol-1
C.-(-4a+6b+4c-5d)kJ·mol-1
D.-(4a-6b-4c+5d)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g)+I2(?)![]() 2HI(g)ΔH=+9.48kJ·mol-1
2HI(g)ΔH=+9.48kJ·mol-1
②H2(g)+I2(?)![]() 2HI(g)ΔH=-26.48kJ·mol-1
2HI(g)ΔH=-26.48kJ·mol-1
下列判断正确的是( )
A.①中的I2为固态,②中的I2为气态
B.①的反应物总能量比②的反应物总能量高
C.①的产物比反应②的产物热稳定性更好
D.1mol固态碘升华需吸热17kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com