
����Ŀ�����ж����⻯�����NH3��N2H4��;��Ϊ�㷺��
��1��һ�������£���3 L�ܱ������г���4 mol N2��9 mol H2�ϳɰ����¶�ΪT1ʱ��ƽ��ʱNH3�����ʵ���Ϊ2.4 mol���¶�ΪT2ʱ��ƽ��ʱNH3�����ʵ���Ϊ2.0mol��
��֪���ƻ�1 molN2(g)��3 molH2(g)�еĻ�ѧ�����ĵ�������С���ƻ�2molNH3(g)�еĻ�ѧ�����ĵ�������
����T1 ____________T2������>������<������=������
����T2 �£�����10min��Ӧ�ﵽ��ѧƽ��״̬����0~10min��H2��ƽ����Ӧ����v(H2)= __________��ƽ��ʱN2��ת������(N2)=__________��ƽ���������������Ũ�ȣ��÷�Ӧ��ƽ�ⳣ��__________������������������С����������������
��2����(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���������ȼ�ϵ����һ�ּ���ȼ�ϵ�أ���������Ⱦ���������Һ��20%��30%��KOH��Һ����������ȼ�ϵ�طŵ�ʱ�������ĵ缫��Ӧʽ��__________________________������������Һ��pH________������������������С����������������
��3���������۷ɴ��ij����������(N2H4����̬)Ϊȼ�ϣ�Ϊ������£�N2H4��ȼ�չ������ͷŵ�����������NO2������������O2�������߷�Ӧ����N2��ˮ��������֪����N2(g)��2O2(g)===2NO2(g) ��H1����67.7kJ��mol��1 ��N2H4(g)��O2(g)===N2(g)��2H2O(g) ��H2����534 kJ��mol��1��д���º�NO2��ȫ��Ӧ���Ȼ�ѧ����ʽ��______________________________��
���𰸡� �� 0.1mol/(L��min) 25% ���� N2H4��4e��+4OH��=N2+4H2O ���� 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H= ��1135.7 kJ��mol��1
����������1��������������ԭ������ѧƽ��ļ��㣬���ƻ�1 molN2(g)��3 molH2(g)�еĻ�ѧ�����ĵ�������С���ƻ�2molNH3(g)�еĻ�ѧ�����ĵ�������˵���˷�Ӧ�Ƿ��ȷ�Ӧ���¶�T1�ﵽƽ��ʱ��n(NH3)=2.4mol���¶�ΪT2ƽ��ʱn(NH3)=2.0mol������Ӧ�����Ƿ��ȷ�Ӧ�������¶����ߣ�ƽ�����淴Ӧ������У���T1<T2���ںϳɰ���ѧ��Ӧ����ʽΪN2��3H2![]() 2NH3������NH3�����ʵ���Ϊ2.0mol���������������ʵ���Ϊ2.0��3/2mol=3.0mol�����ݻ�ѧ��Ӧ������ѧ����ʽ��v(H2)=3.0/(10��3)mol/(L��min)=0.1mol/(L��min)������N2�����ʵ���Ϊ1mol����N2��ת����Ϊ1/4��100%=25%����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬����������Ũ�ȣ���ѧƽ�ⳣ�����䣻��2������ԭ��صĹ���ԭ���͵缫��Ӧʽ����д������������Ⱦ�����N2H4ת����N2����Ϊ�����Ǽ��ԣ���˸����缫��ӦʽΪN2H4��4OH����4e��=N2��4H2O��������ӦʽΪO2��2H2O��4e��=4OH�����������������Һ��pH����3�������Ȼ�ѧ��Ӧ����ʽ�ļ��㣬����NO2�ķ�Ӧ����ʽΪ2N2H4��2NO2=3N2��4H2O���ڡ�2���ٵó���H=��1135.7kJ��mol��1���Ȼ�ѧ��Ӧ����ʽΪ��2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H= -1135.7 kJ��mol��1��
2NH3������NH3�����ʵ���Ϊ2.0mol���������������ʵ���Ϊ2.0��3/2mol=3.0mol�����ݻ�ѧ��Ӧ������ѧ����ʽ��v(H2)=3.0/(10��3)mol/(L��min)=0.1mol/(L��min)������N2�����ʵ���Ϊ1mol����N2��ת����Ϊ1/4��100%=25%����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬����������Ũ�ȣ���ѧƽ�ⳣ�����䣻��2������ԭ��صĹ���ԭ���͵缫��Ӧʽ����д������������Ⱦ�����N2H4ת����N2����Ϊ�����Ǽ��ԣ���˸����缫��ӦʽΪN2H4��4OH����4e��=N2��4H2O��������ӦʽΪO2��2H2O��4e��=4OH�����������������Һ��pH����3�������Ȼ�ѧ��Ӧ����ʽ�ļ��㣬����NO2�ķ�Ӧ����ʽΪ2N2H4��2NO2=3N2��4H2O���ڡ�2���ٵó���H=��1135.7kJ��mol��1���Ȼ�ѧ��Ӧ����ʽΪ��2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H= -1135.7 kJ��mol��1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���Ѷ�Ӧ���ʵ���ĸ��������������.
A.ˮ���� B.���� C.Ũ���� D.�������� E.������ˮ F.С�մ� G�������
����ʹʯ����Һ�ȱ�����ɫ___________��
������ľ�ķ����___________��
����������θ������һ��ҩ��____________��
��2���ۺϿ��Ǿ��á������������ȷ������أ������ͭΪԭ����ȡ����ͭ�����·��ͼ����:![]()
·��ͼΪ:________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е�˵������ȷ���ǣ� ��
A. 1 mol FeI2 ��������������Ӧʱת�Ƶĵ�����Ϊ3 NA
B. 12 mol/L��Ũ����50 ml ��������Cu���ȷ�Ӧ���õ�SO2Ϊ0.3 mol
C. ����һ�����ʵ���Ũ����Һʱ����Һ�����������ƿ������һ��
D. 1 mol NaHSO4�����к���������Ϊ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ�ص�ԭ�Ӱ뾶��ijЩ���ϼۼ��±��������ж�����˵����ȷ����(����)
Ԫ�ش��� | A | B | D | E | X | Y | Z | W |
���ϼ� | -1 | -2 | +4��-4 | -1 | +5��-3 | +3 | +2 | +1 |
ԭ�Ӱ뾶/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A. A�ĵ����ܽ�E���ʴ�YE3����Һ���û�����
B. A��Y��W�����Ӱ뾶�ɴ�С˳����A>W>Y
C. XԪ�صĵ��ʲ�����ͬ��������
D. Z��DB2��ȼ���������ֻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����BF3�����У�F��B��F�ļ�����________��Bԭ�ӵ��ӻ��������Ϊ________��BF3����NaF���ÿ�����NaBF4��BF4-�����幹��Ϊ________��
��2����Ҫ��д���ɵڶ�����Ԫ��Ϊ����ԭ�ӣ�ͨ��sp3�ӻ��γ����Է��ӵĻ�ѧʽ����дһ�֣��������������__________�������η���__________��V�ͷ���__________��
��3����֪����(P4)�ĽṹΪ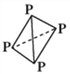 ����֪ÿ����ԭ����___�����ۼ��������___��ԭ�ӽ�ϳ���������ṹ����Ӧ����________����(����ԡ��Ǽ��ԡ�)����CS2��______(��ܡ����ܡ�)�ܽ⣬Pԭ�ӵ��ӻ���ʽΪ______________��
����֪ÿ����ԭ����___�����ۼ��������___��ԭ�ӽ�ϳ���������ṹ����Ӧ����________����(����ԡ��Ǽ��ԡ�)����CS2��______(��ܡ����ܡ�)�ܽ⣬Pԭ�ӵ��ӻ���ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
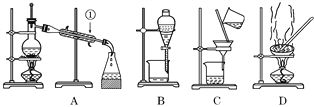
��1�����Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ��______(����ĸ����ͬ)����ȥ����ˮ�еĿ��������ʣ�ѡ��װ��__________��
��2���ӵ�ˮ�з����I2��ѡ��װ��________���÷��뷽��������Ϊ________________________��
��3��װ��A�Т���ˮ�Ľ���������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ΪFeBr2��FeI2����Һ��ͨ��һ����������������Ӧ�����Һ�еμ�KSCN��Һ�������Һ��ΪѪ��ɫ����������������ȷ���� (����)
A. ԭ��Һ�е�Br����һ��������
B. ͨ������֮��ԭ��Һ�е�Fe2��һ��������
C. ����ȷ��ͨ������֮�����Һ���Ƿ����Fe2��
D. ��ȡ����������Һ���ټ���CCl4��Һ�����á���Һ�����ϲ���Һ�м���������AgNO3��Һ���ܲ�����ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1-�������һ����Ҫ���л��ϳ��м��壬�е�Ϊ71�棬�ܶ�Ϊ136g��cm-3��ʵ�����Ʊ�����1-��������Ҫ�������£�
����1��������A�м��������ӡ�12g��������20mL ˮ����ˮ��ȴ�»�������28ml ŨH2SO4����ȴ�����£������¼���24gNaBr��(��֪��2NaBr+H2SO4(Ũ) ![]() Na2SO4+2HBr��)
Na2SO4+2HBr��)
����2����ͼ��ʾ�ʵ��װ�ã��������ȣ�ֱ������״�����Ϊֹ��
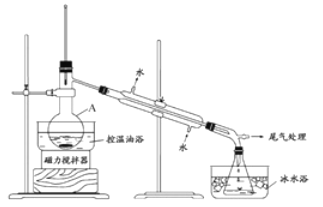
����3�������Һת���Һ©�����ֳ��л��ࡣ
����4�����ֳ����л���ת���Һ©����������12mLH2O��12ml5%Na2CO3��Һ��12mLH2Oϴ�ӣ���Һ���ôֲ�Ʒ����һ���ᴿ��1-����顣
(1)����A��������_____________�����������ӵ�Ŀ���ǽ����_____________��
(2)��Ӧʱ���ɵ���Ҫ�л�������2-������_________________(���һ�ּ��ɸ���)
(3)����2���������ƿ�ڼ���������ˮ�����ڱ�ˮԡ�е�Ŀ����________________��
(4)����1��ŨH2SO4��ˮϡ�ͣ�����ȴ�����º��ټ�NaBr��Ŀ����_____________������4����Na2CO3��Һϴ�ӵ�Ŀ����______________________��
(5)����4�н�һ���ᴿ1-�����ķ�����_________________���ڽ��д˲���֮ǰ��Ҫ����ˮMgBr2�����ֲ�Ʒ����Ŀ����______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵������ȷ����
A. 4.4g ��CO2��N2O ��ɵĻ�������к��е�ԭ������Ϊ0.3NA
B. 0.1mol H2��0.1molI2 ���ܱ������г�ַ�Ӧ�����������Ϊ0.2NA
C. 1.8g18O2�к��е�������ΪNA
D. 5.6g ������2.24L( ��״����)������ȼ�գ�ת�Ƶĵ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com