
| 27g/mol |
| 3 |
| 27g/mol |
| 3 |
| 1mol×11.2L |
| 22.4L |
. |
| M |
| 10g |
| 0.5mol |


科目:高中化学 来源: 题型:
 +NaOH
+NaOH| 醇 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
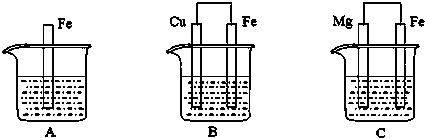
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、K+、Cl-、NO3- |
| B、OH-、Cl-、Na+、NH4+ |
| C、H+、K+、Fe2+、NO3- |
| D、I-、Cl-、H+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和碳酸钠溶液除去二氧化碳中的氯化氢 |
| B、将浓硝酸滴入某些蛋白质溶液中而显黄色,称为焰色反应 |
| C、电解熔融氯化镁制取金属镁 |
| D、实验室制乙酸乙酯时,用水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、1:1 |
| C、4:1 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B、若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C、达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |
| D、若达到平衡时,共放出46.2kJ热量,则有l mol NH3(g)生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com