
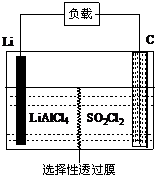
 为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示.已知电池总反应为:2Li+SO2Cl2═2LiCl+SO2↑.下列说法中不正确的是( )
为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示.已知电池总反应为:2Li+SO2Cl2═2LiCl+SO2↑.下列说法中不正确的是( )| A. | 电池的负极反应为:2Li-2e-═2Li+ | |
| B. | 工作时电流方向:锂电极→导线→负载→碳棒 | |
| C. | 正极电极反应为:SO2Cl2+2e-═2Cl-+SO2↑ | |
| D. | 电池工作时,会在碳棒表面看到气泡产生 |
分析 根据电池反应式知,放电时Li元素化合价由0价变为+1价,所以Li是负极,反应为:2Li-2e-═2Li+,碳棒是正极,正极是SO2Cl2中+6价的硫得电子发生还原反应,所以电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑,电流从正极流向负极,据此回答.
解答 解:A、放电时,失电子化合价升高的电极是负极,根据电池反应式知,放电时Li元素化合价由0价变为+1价,所以Li是负极,反应为:2Li-2e-═2Li+,故A正确;
B.放电时,Li是负极,另一个电极是正极,负极上失电子、正极上得电子,所以电子从负极沿导线流向正极,和电流方向相反,即电流方向:C电极→导线→负载→Li电极,故B错误;
C.正极是SO2Cl2中+6价的硫得电子发生还原反应,所以电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑,故C正确;
D.电池工作时,碳棒是正极,电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑,会在碳棒表面看到气泡产生,故D正确;
故选B.
点评 本题考查了新型化学电池,明确原电池、电解池判断方法是解本题关键,难点是电极反应式的书写,要结合电池反应式及元素化合价变化书写,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液,pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | a mol/L HCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c( Na+)>c(CN-),则a 一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 将少量的H2S通入NaCN溶液中,反应为:H2S+2CN-=2HCN+S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是制造太阳能电池板的主要材料 | |
| B. | NO、NO2是大气污染物,能在空气中稳定存在 | |
| C. | 漂白精的有效成分是Ca(ClO)2 | |
| D. | Fe与S化合生成Fe2S3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用碳酸钠与醋酸溶液制取少量二氧化碳 | |
| B. | 将NaHCO2与Al2(SO4)3两种溶液配制泡沫灭火剂 | |
| C. | 热的纯碱溶液的去污能力更强 | |
| D. | 实验室用饱和的FeCl3溶液制取氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使石蕊试液变红色的溶液中:Na+、CO32-、K+、ClO-、I- | |
| B. | 能与金属铝反应放出H2的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20mol/L的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 中性溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
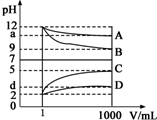 物质A~D为CH3COOH、NaOH、HCl、NH3•H2O中的各一种,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如图所示.请回答下列问题:
物质A~D为CH3COOH、NaOH、HCl、NH3•H2O中的各一种,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
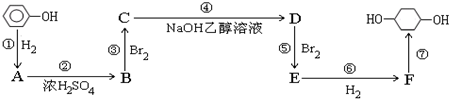
 ,F
,F ;A含有的官能团名称是羟基;
;A含有的官能团名称是羟基;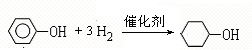 ;
; +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$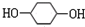 +2NaBr.
+2NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0020 | 0.0032 | 0.0040 | 0.0040 |
| A. | 前20min的反应速率v(H2O)=2.5×10-5mol•L-1•min-1 | |
| B. | 达平衡时,至少需要从外界吸收的能量为0.968kJ | |
| C. | 增大c(H2O),可以提高水的分解率 | |
| D. | 使用纳米级Cu2O颗粒是为了提高催化效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 硫酸溶液与氯化钡溶液混合:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com