
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | K2O的电子式: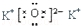 | |
| C. | 2-乙基-1,3-丁二烯分子的键线式: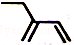 | |
| D. | 比例模型  可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |
分析 A.质子数+中子数=质量数;
B.氧化钾为离子化合物,两个钾离子与阳离子通过离子键结合;
C.键线式表示方法:碳碳键用线段来表现,画出键线式.拐点和端点表示碳原子,碳原子,H不必标出,杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略;
D.二氧化硅为原子晶体.
解答 解:A.中子数为20的氯原子,质量数为20+17=37,符号为:${\;}_{17}^{37}$Cl,故A正确;
B.氧化钾为离子化合物,两个钾离子与阳离子通过离子键结合,电子式: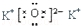 ,故B正确;
,故B正确;
C.2-乙基-1,3-丁二烯的结构简式为 ,键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,所以2-乙基-1,3-丁二烯的键线式为:
,键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,所以2-乙基-1,3-丁二烯的键线式为: ,故C正确;
,故C正确;
D.比例模型  可以表示CO2分子,不能表示二氧化硅,二氧化硅为原子晶体,故D错误;
可以表示CO2分子,不能表示二氧化硅,二氧化硅为原子晶体,故D错误;
故选:D.
点评 本题考查了化学用语,涉及电子式、键线式、原子符合的书写,物质的比例模型,熟悉常用化学用语的表示方法是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | L、M的单质与稀硫酸反应速率:M>L | |
| C. | T、Q的氢化物常态下均为无色气体 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+:1s22s22p6 | B. | F:1s22s22p5 | ||
| C. | Cl-:1s22s22p63s23p5 | D. | Mn:1s22s22p63s23p63d54s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、H2、SO2 | B. | SO2、H2S、O2 | C. | HCl、CO2、H2S | D. | H2、SO2 、NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间 | CO2 (mol) | H2 (mol) | CH3OH (mol) | H2O (mol) |
| 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉辨别真假葡萄酒 | |
| B. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| C. | 金属的防护中,牺牲阳极的阴极保护法利用的是原电池原理 | |
| D. | 84消毒液在日常生活中广泛应用,其有效成分是Ca(ClO)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消去→加成→取代 | B. | 加成→消去→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com