
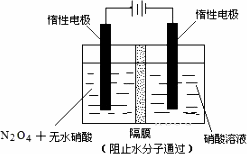
N2O5ЪЧвЛжжаТаЭЯѕЛЏМСЃЌЦфаджЪКЭжЦБИЪеЕНШЫУЧЕФЙизЂЃЎ
(1)вЛЖЈЮТЖШЯТЃЌдкКуШнУмБеШнЦїжаN2O5ПЩЗЂЩњЯТСаЗДгІЃК2N2O5(g)![]() 4NO2(g)ЃЋO2(g)ЃЛІЄHЃО0
4NO2(g)ЃЋO2(g)ЃЛІЄHЃО0
ЂйШєЗДгІДяЕНЦНКтКѓЃЌЭЈШывЛЖЈСПЕЊЦјЃЌдђN2O5ЕФзЊЛЏТЪНЋ________(ЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЁЂЁАВЛБфЁБ)ЃЎ
ЂкЯТБэЮЊЗДгІдкT1ЮТЖШЯТЕФВПЗжЪЕбщЪ§ОнЃК
дђ500 sФкN2O5ЕФЗжНтЫйТЪЮЊ________ЃЎ
ЂлдкT2ЮТЖШЯТЃЌЗДгІ1000 sЪБВтЕУNO2ЕФХЈЖШЮЊ4.98 mol/LЃЌдђT2________T1ЃЎ
(2)ШчЭМЫљЪОзАжУПЩгУгкжЦБИN2O5ЃЌдђN2O5дкЕчНтГиЕФ________ЧјЩњГЩ(ЁАвѕМЋЁБЛђЁАбєМЋЁБ)ЃЌЦфЕчМЋЗДгІЪНЮЊ________
 99Мг1СьЯШЦкФЉЬибЕОэЯЕСаД№АИ
99Мг1СьЯШЦкФЉЬибЕОэЯЕСаД№АИ АйЧПУћаЃЦкФЉГхДЬ100ЗжЯЕСаД№АИ
АйЧПУћаЃЦкФЉГхДЬ100ЗжЯЕСаД№АИ КУГЩМЈ1Мг1ЦкФЉГхДЬ100ЗжЯЕСаД№АИ
КУГЩМЈ1Мг1ЦкФЉГхДЬ100ЗжЯЕСаД№АИ Н№зДдЊМЈгХКУОэЯЕСаД№АИ
Н№зДдЊМЈгХКУОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
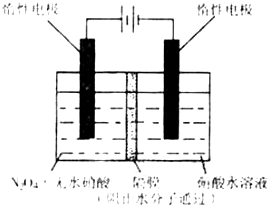 ЃЈ2008?жиЧьЃЉN2O5ЪЧвЛжжаТаЭЯѕЛЏМСЃЌЦфаджЪКЭжЦБИЪмЕНШЫУЧЕФЙизЂЃЎ
ЃЈ2008?жиЧьЃЉN2O5ЪЧвЛжжаТаЭЯѕЛЏМСЃЌЦфаджЪКЭжЦБИЪмЕНШЫУЧЕФЙизЂЃЎ
| t/s | 0 | 500 | 1000 |
| eЃЈN2O5ЃЉ/mol?L-1 | 5.00 | 3.52 | 2.48 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃКдФЖСРэНт
 ЂёЃЎXЁЂYЁЂZЪЧЖЬжмЦкдЊЫиЕФШ§жжГЃМћбѕЛЏЮяЃЎXИњЫЎЗДгІПЩЩњГЩвЛжжОпгаЛЙдадЕФВЛЮШЖЈЕФЖўдЊЫсЃЌИУЫсЕФЛЏбЇЪНЪЧ
ЂёЃЎXЁЂYЁЂZЪЧЖЬжмЦкдЊЫиЕФШ§жжГЃМћбѕЛЏЮяЃЎXИњЫЎЗДгІПЩЩњГЩвЛжжОпгаЛЙдадЕФВЛЮШЖЈЕФЖўдЊЫсЃЌИУЫсЕФЛЏбЇЪНЪЧ
| ||
| ||
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЃЈ1ЃЉN2O5гыБНЗЂЩњЯѕЛЏЗДгІЩњГЩЕФЯѕЛљБНЕФНсЙЙМђЪНЪЧ____________________________ЁЃ
ЃЈ2ЃЉвЛЖЈЮТЖШЯТЃЌдкКуШнУмБеШнЦїжаN2O5ПЩЗЂЩњЯТСаЗДгІЃК
2N2O5ЃЈgЃЉ![]() 4NO2ЃЈgЃЉ+O2ЃЈgЃЉЃЛІЄHЃО0
4NO2ЃЈgЃЉ+O2ЃЈgЃЉЃЛІЄHЃО0
ЂйЗДгІДяЦНКтКѓЃЌШєдйЭЈШывЛЖЈСПЕЊЦјЃЌдђN2O5ЕФзЊЛЏТЪНЋ___________ЁЃЃЈЬюЁАЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉ
ЂкЯТБэЮЊЗДгІдкT1ЮТЖШЯТЕФВПЗжЪЕбщЪ§ОнЃК
t/s | 0 | 500 | 1 000 |
cЃЈN2O5ЃЉ/molЁЄL-1 | 5.00 | 3.52 | 2.48 |
дђ500 sФкN2O5ЕФЗжНтЫйТЪЮЊ__________ЁЃ
ЂлдкT2ЮТЖШЯТЃЌЗДгІ1 000 sЪБВтЕУNO2ЕФХЈЖШЮЊ4.98 molЁЄL-1ЃЌдђT2___________T1ЁЃ
ЃЈ3ЃЉЯТЭМЫљЪОзАжУПЩгУгкжЦБИN2O5ЃЌдђN2O5дкЕчНтГиЕФ_______ЧјЩњГЩЃЌЦфЕчМЋЗДгІЪНЮЊ____________________________________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
N2O5ЪЧвЛжжаТаЭЯѕЛЏМСЃЌЦфаджЪКЭжЦБИЪмЕНШЫУЧЕФЙизЂЁЃ![]()
![]()
![]()
![]()
![]()
![]()
![]()
ЃЈ1ЃЉN2O5гыБНЗЂЩњЯѕЛЏЗДгІЩњГЩЕФЯѕЛљБНЕФНсЙЙМђЪНЪЧ ЁЃ
ЃЈ2ЃЉвЛЖЈЮТЖШЯТЃЌдкКуШнУмБеШнЦїжаN2 O5ПЩЗЂЩњЯТСаЗДгІЃК
![]() 2N2O5ЃЈgЃЉ 4NO2ЃЈgЃЉ+O2(g);ІЄHЃО0
2N2O5ЃЈgЃЉ 4NO2ЃЈgЃЉ+O2(g);ІЄHЃО0
ЂйЗДгІДяЦНКтКѓЃЌШєдйЭЈШывЛЖЈСПЕЊЦјЃЌдђN2O5ЕФзЊЛЏТЪНЋ ЁЃЃЈЬюЁАдіДѓЁБЛђЁАМѕаЁЁБЁЂЁАВЛБфЁБЃЉ
ЂкЯТБэЮЊЗДгІдкT1ЮТЖШЯТЕФВПЗжЪЕбщЪ§ОнЃК
| t/s | 0 | 500 | 1000 |
| c(N2O5)/molЁЄL-1 | 5.00 | 3.52 | 2.48 |
дђ500sФкN2O5ЕФЗжНтЫйТЪЮЊ ЁЃ
ЂлдкT3ЮТЖШЯТЃЌЗДгІ1 000 sЪБВтЕУNO2ЕФХЈЖШЮЊ4.98 molЁЄL-1ЃЌдђT2 T1ЁЃ
 |
ЃЈ3ЃЉШчЩЯЭМЫљЪОзАжУПЩгУгкжЦБИN2O5ЃЌдђN2O5дкЕчНтГиЕФ
ЧјЩњГЩЃЌЦфЕчМЋЗДгІЪНЮЊ .
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
Ђё.ИЧЫЙЖЈТЩдкЩњВњКЭПЦбЇбаОПжагаКмживЊЕФвтвхЁЃгааЉЗДгІЕФЗДгІШШЫфШЛЮоЗЈжБНгВтЕУЃЌЕЋПЩЭЈЙ§МфНгЕФЗНЗЈВтЖЈЁЃЯжИљОнЯТСаЕФ5ИіЗДгІ(гЩАБЦјЁЂHClКЭЫЎжЦБИNH4C1ЫЎШмвК)ЁЃЧыХаЖЯЗДгІЂмЕФЗДгІШШЃКІЄHЃН ЁЃ
Ђй NH3(g) + HCl(g) = NH4Cl(s) ІЄH=Ѓ176kJЁЄmolЈC1
Ђк NH3(g) + H2O(l) = NH3(aq) ІЄH=Ѓ35.1 kJЁЄmolЈC1
Ђл HCl(g) + H2O(l) = HCl(aq) ІЄH=Ѓ72.3 kJЁЄmolЈC1
Ђм NH4C1(s) + H2O(1) = NH4C1(aq)
Ђн NH3(aq) + HCl(aq) = NH4C1(aq) ІЄH= Ѓ52.3 kJЁЄmolЈC1
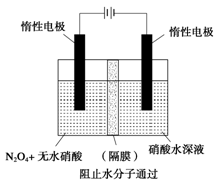
Ђђ. N2O5ЪЧвЛжжаТаЭЯѕЛЏМСЃЌЦфаджЪКЭжЦБИЪмЕНШЫУЧЕФЙизЂЁЃЯжвдH2ЁЂO2ЁЂШлШкбЮNa2CO3зщГЩЕФШМСЯЕчГиЃЌВЩгУЕчНтЗЈжЦБИN2O5ЃЌзАжУШчЭМЫљЪОЃЌЦфжаYЮЊCO2ЁЃ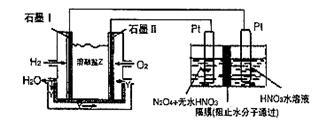
аДГіЪЏФЋIЕчМЋЩЯЗЂЩњЗДгІЕФЕчМЋЗДгІЪН ЁЃ
дкЕчНтГижаЩњГЩN2O3ЕФЕчМЋЗДгІЪНЮЊ ЁЃ
Ђѓ.бЬЦјЕФЭбСђЃЈГ§SO2ЃЉММЪѕКЭЭбЯѕЃЈГ§NOxЃЉММЪѕЖМЪЧЛЗОГПЦбЇбаОПЕФШШЕуЁЃ
ЂХбЬЦјЭбСђЁЂЭбЯѕЕФЛЗОГвтвхЪЧ ЁЃ
(2)ФПЧАЃЌПЦбЇМве§дкбаОПвЛжжвдввЯЉзїЮЊЛЙдМСЕФЭбЯѕЃЈNOЃЉдРэЃЌЦфЭбЯѕЛњРэЪОвтЭМШчЯТЭМ1ЃЌЭбЯѕТЪгыЮТЖШЁЂИКдиТЪЃЈЗжзгЩИжаДпЛЏМСЕФжЪСПЗжЪ§ЃЉЕФЙиЯЕШчЭМ2ЫљЪОЁЃ
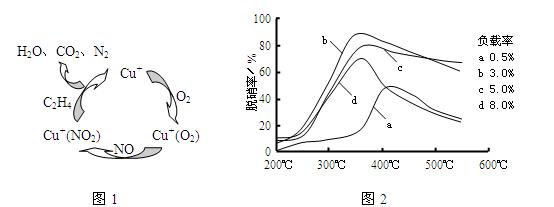
ЂйаДГіИУЭбЯѕдРэзмЗДгІЕФЛЏбЇЗНГЬЪНЃК ЁЃЂкЮЊДяЕНзюМбЭбЯѕаЇЙћЃЌгІВЩШЁЕФЬѕМўЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com