
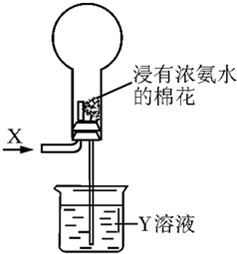
| A、若X为HCl,则烧瓶内可产生白雾 |
| B、选择适当的X和Y溶液可产生有色喷泉 |
| C、若烧瓶内产生喷泉,则Y溶液一定呈酸性 |
| D、若通入气体为Cl2,则烧瓶内一定无喷泉产生 |


科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、不会在空气中燃烧的气体,但能使带火星的木条复燃.
为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、不会在空气中燃烧的气体,但能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应达到平衡时,c(Cu2+)=c(Mn2+) |
| B、平衡体系中加入少量CuS(s) 后,c( Mn2+) 变小 |
| C、平衡体系中加入少量Cu(NO3) 2(s) 后,c( Mn2+) 变大 |
| D、该反应平衡常数表达式:K=Ksp(CuS)/Ksp(MnS) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com