
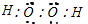 ,
,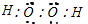 ;
;
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、13.5 g Al与足量盐酸反应生成H2的分子数为NA |
| B、标准状况下,2.24 L CH4所含电子数为NA |
| C、500 mL 1 mol?L-1的K2SO4溶液中含有K+数目为NA |
| D、0.5 mol O2和0.5 mol O3的混合物所含有的氧原子个数为2.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
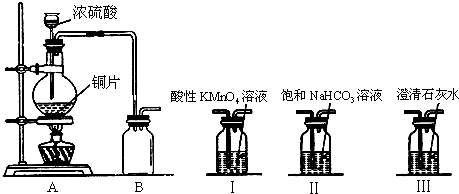
查看答案和解析>>
科目:高中化学 来源: 题型:
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH |
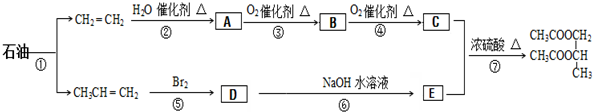

查看答案和解析>>
科目:高中化学 来源: 题型:
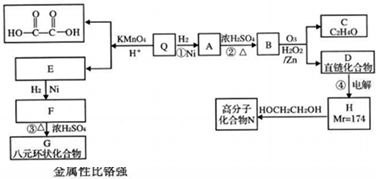
| KMnO4/H+ |
| O3 |
| H2O2/Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com