
【题目】二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为___________________________;向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
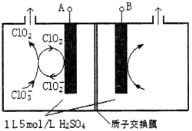
①电源负极为___________________极(填A或B)
②写出阴极室发生反应的电极反应式和离子方程式
_______________________ ___ ; 。
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2—歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为_________________。
【答案】(1)5ClO2-+4H+=4ClO2↑+Cl-+2H2O ;反应生成的Cl-对反应起催化作用 ;
(2)H2O2做还原剂时氧化产物为O2,而盐酸则产生大量Cl2;
(3) ①A;②ClO2+e-= ClO2- ;ClO3-+ ClO2-+2H+= 2ClO2↑+ H2O;③ 0.8mol/L
【解析】
试题分析:(1)亚氯酸钠在强酸性溶液中会发生歧化反应,产生ClO2气体,根据题意,结合原子守恒、电子守恒及电荷守恒的知识可得该反应的离子方程式为5ClO2-+4H+=4ClO2↑+Cl-+2H2O。在pH相同的盐酸中的反应速率比硫酸中快,说明溶液中的Cl-可能会影响化学反应速率;一段时间后在硫酸中的反应速率也加快,这是由于发生反应5ClO2-+4H+=4ClO2↑+Cl-+2H2O,随着反应的进行,溶液中Cl-的浓度增大了,所以产生气体速率迅速加快的原因是反应生成的Cl-对反应起催化作用。
(2)用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是H2O2做还原剂时氧化产物为O2,而盐酸则产生大量Cl2;O2是大气的成分,而Cl2是大气污染物,会对环境造成危害。
(3)①根据题图中物质所含元素的化合价的变化情况可以看出:A电极所连接的电极发生还原反应,是电解池的阴极,所以A为电源的负极,B为电源的正极。
②根据题图可知阴极室发生反应依次为ClO2+e-= ClO2- ;ClO3-+ ClO2-+2H+= 2ClO2↑+ H2O。
③在整个闭合回路中电子转移数目相等。阴极室每产生4mol的ClO2电子转移4mol,同时在阳极室发生反应:4OH--4e-=2H2O+ O2↑,产生1mol的O2。因此转移4mol电子,一共产生5mol气体。现在产生气体的物质的量为1mol,所以转移电子0.8mol,在阳极有0.8mol的OH-离子放电,因为溶液的体积为1L。所以此时阳极室与阴极室c(H+)之差为0.8mol/L。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,请根据元素①-⑧在表中的位置,用化学用语回答下列问题:
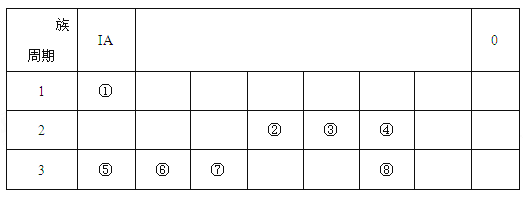
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是 (用化学式表示,下同);碱性最强的是 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序是 (用离子符号表示)。
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有: 。
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族) 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
![]()
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行。B的化学式为 。对应的反应①的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
![]()
A. W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B. Z元素的最高价氧化物水化物的酸性强于Y
C. 四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D. 向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2 +2Ag+2NaCl=Na2Mn5O10 +2AgCl
①该电池的负极反应式是______________;
②在电池中,Na + 不断移动到“水”电池的_______极(填“正“或“负”);
③外电路每通过4mol电子时,生成Na2 Mn5 O10 的物质的量是_______。
(2)中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如下图所示:
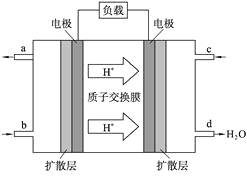
①该电池工作时,b口通入的物质为____________。
②该电池负极的电极反应式 。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。
(3)Ag2O是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液时,电池放电时正极的Ag2O转化为Ag,负极的Zn转化为Zn(OH)2,写出该电池反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应 | 化学方程式 | 焓变△H | 正反应活化能Ea |
甲烷 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
蒸汽 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
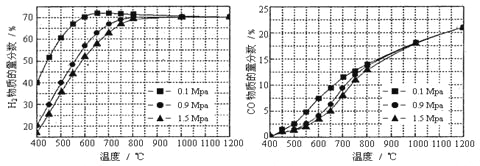
①若要达到H2物质的量分数>65%/span>、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9Mpa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COOH的电离方程式为CH3COOH![]() CH3COO-+H+。在0.1 mol·L-1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:
CH3COO-+H+。在0.1 mol·L-1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:
(1)向醋酸中加入醋酸钠固体,电离平衡 移动(填“向左”“向右”或“不”,下同);c(H+) (填“增大”“减小”或“不变”,下同),pH 。
(2)向醋酸中加入碳酸钙固体,电离平衡向 移动;c(CH3COOH) 。
(3)向醋酸中加入大量的水,c(OH-) 。导电能力 ,电离平衡常数 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.只用一种试剂来鉴别下列各组物质:
(1)甲醇、乙醛、乙酸,选用的试剂是 。
(2)乙酸、甲酸甲酯、乙酸乙酯,选用的试剂是 。
(3)苯、四氯化碳、1—已烯、苯酚的水溶液,选用的试剂是 。
Ⅱ.立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示:
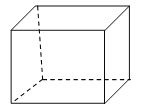
(1)“立方烷”的分子式是 ;“立方烷”有多种同分异构体,其中一种属于芳香烃的同分异构体的结构简式是 。
(2)“立方烷”的二氯代物具有同分异构体的数目是 。“立方烷”的三氯代物具有同分异构体的数目是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。

请回答下列问题:
(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为: 。
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置 (填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料: 。当反应中收集到标准状况下224mL气体时,消耗的电极质量为 g。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能直接转化为电能。
现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入 极(填a或b,下同),电子从 极流出,电解质溶液中OH-向 极移动。
(4)等质量的下列物质分别完全燃烧,放出热量较多的是 (填编号)
A.固体硫, B.硫蒸气.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1molL-1CH3COONa溶液中,不断通入HCl气体。CH3COO-与CH3COOH 的变化趋势如图所示(假设HCl完全吸收且不考虑CH3COOH挥发及溶液体积变化),下列说法不正确的是
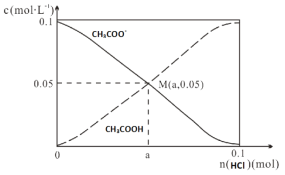
A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(H+)-n(OH-)=(0.05-a )mol
C.随着HCl的加入,![]() 不断减小
不断减小
D.当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com