
| A. | 100 mL | B. | 500 mL | C. | 1 000 mL | D. | 1 500 mL |
分析 加入2mol/L的氢氧化钠溶液,要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,此时溶质为NaCl,根据钠离子与氯离子守恒计算氢氧化钠的物质的量,再根据V=$\frac{n}{c}$计算需加入氢氧化钠溶液的体积.
解答 解:要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,反应后为NaCl溶液,根据钠离子与氯离子守恒可知:n(NaOH)=n(NaCl)=n(HCl)=0.5L×4mol/L=2mol,
所以需氢氧化钠溶液的体积为:$\frac{2mol}{2mol/L}$=1L=1000mL,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应实质及反应后溶质组成为解答关键,注意掌握守恒思想在化学计算中的应用,试题有利于培养学生的化学计算能力.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液时,将硝酸银溶液慢慢滴加到稀氨水中,产生沉淀后继续滴加到沉淀刚好溶解为止 | |
| B. | 鉴别苯和乙酸乙酯:分别加入NaOH溶液加热振荡,观察油层是否消失或变薄 | |
| C. | 配制一定物质的量浓度的溶液时,仰视定容会导致浓度偏高 | |
| D. | 向淀粉溶液中加入稀硫酸,加热,再加入新制银氨溶液,未出现银镜,说明淀粉尚未水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | 邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键 | |
| D. | 若X+和Y2-的核外电子层结构相同,则原子序数:Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L溶液中含有4g NaOH | B. | 1L水中溶解4gNaOH | ||
| C. | 0.5L溶液中含有0.2mol H2SO4 | D. | 9.8g H2SO4溶于1L水配成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.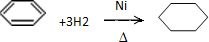 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15种 | B. | 14种 | C. | 13种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
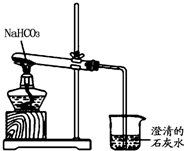 Na2CO3和NaHCO3是两种常见的钠盐.
Na2CO3和NaHCO3是两种常见的钠盐.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com